Hóa học 10 Kết nối tri thức Bài 23: Ôn tập chương 7 được THPT Ngô Thì Nhậm biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 10 Kết nối tri thức Bài 23
1. Nguyên tử halogen
– Cấu hình lớp electron ngoài cùng của các nguyên tử halogen: ns2np5.
– Xu hướng nhận 1 electron trở thành ion halide: X + 1e → X- thể hiện tính oxi hóa của X.
2. Đơn chất halogen
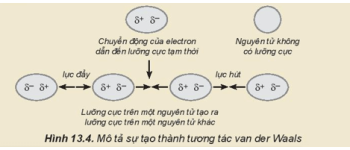
– Xu hưởng biến đổi nhiệt độ nóng chảy, nhiệt độ sôi từ F2 đến I2: tăng dần
Giải thích: Tương tác van der Waals giữa các phân tử tăng và khối lượng phân tử tăng.
– Xu hướng biến đổi tính oxi hoá của các halogen: giảm dần
Giải thích: Độ âm điện giảm dần từ F đến I nên khả năng nhận electron giảm dần từ F đến I.
– Các phản ứng hoá học được sử dụng để điều chế chlorine:
Trong công nghiệp:
2NaCl + 2H2O → 2NaOH + H2 + Cl2.
Trong phòng thí nghiệm:
MnO2 + 4HCl (đặc) → MnCl2 + Cl2 + H2O
Hoặc
2KMnO4 + 16HCl (đặc) → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
3. Hydrogen halide
– Sự biến đổi nhiệt độ sôi của các halogen halide từ HF đến HI: giảm từ HF đến HCl, tăng HCl đến HI.
Giải thích: HF lỏng có nhiệt độ sôi cao bất thường là do phân tử HF phân cực mạnh, có khả năng tạo liên kết hydrogen ; còn từ HCl đến HI, nhiệt độ sôi tăng do:
+ Lực tương tác van der Waals giữa các phân tử tăng
+ Khối lượng phân tử tăng.
– Xu hướng biến đổi tính acid từ HF đến HI tăng dần.
Giải thích: năng lượng liên kết giữa hydrogen với halogen giảm dần từ HF đến HI nên độ linh động của nguyên tử hydrogen tăng dần từ HF đến HI.
4. Muối halide
– Cách phân biệt các ion F-, Cl-, Br-, I- trong dung dịch muối và acid: dùng dung dịch AgNO3.
– Sắp xếp các ion Cl-, Br-, I- theo thứ tự tính khử tăng dần: Cl-, Br-, I-.
Giải bài tập SGK Hóa học 10 Kết nối tri thức Bài 23
Câu 1 trang 118 Hóa học 10
Liên kết trong phân tử nào sau đây có độ phân cực lớn nhất?
A. H – F
B. H – Cl
C. H – Br
D. H – I
Lời giải:
Đáp án A
Liên kết trong phân tử HF có độ phân cực lớn nhất. Vì
– Các phân tử trên đều có dạng H – X (X: halogen)
– Phân tử được hình thành bởi liên kết cộng hóa trị phân cực. Cặp electron góp chung bị lệch về phía có độ âm điện lớn hơn.
⇒ Nguyên tử X có độ âm điện càng lớn thì liên kết càng phân cực.
⇒ Flo là nguyên tố halogen có độ âm điện lớn nhất và bán kính nguyên tử nhỏ hơn các halogen khác nên phân tử H – F sẽ phân cực nhất so với H – Cl, H – Br, H – I.
Câu 2 trang 118 Hóa học 10
Trong nhóm halogen, từ F đến I, bán kính nguyên tử biến đổi theo chiều nào?
A. Giảm dần.
B. Không đổi.
C. Tăng dần.
D. Tuần hoàn.
Lời giải:
Đáp án đúng là: C
Trong nhóm halogen, từ F đến I, bán kính nguyên tử tăng dần do số lớp electron tăng dần, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm.
Câu 3 trang 118 Hóa học 10
Trong dãy đơn chất từ F2 đến I2, chất có tính oxi hoá mạnh nhất là
A. F2.
B. Cl2.
C. Br2.
D. I2.
Lời giải:
Đáp án đúng là: A
Trong dãy đơn chất từ F2 đến I2, chất có tính oxi hoá mạnh nhất là F2. Vì F2 là phi kim mạnh nhất.
Câu 4 trang 118 Hóa học 10
Khi tiến hành điều chế và thu khí Cl2 vào bình, để ngăn khí Cl2 thoát ra ngoài gây độc, cần đậy miệng bình thu khí Cl2 bằng bông có tẩm dung dịch
A. NaCl.
B. HCl.
C. NaOH.
D. KCl.
Lời giải:
Đáp án đúng là: C
Khi tiến hành điều chế và thu khí Cl2 vào bình, để ngăn khí Cl2 thoát ra ngoài gây độc, cần đậy miệng bình thu khí Cl2 bằng bông có tẩm dung dịch NaOH. Vì NaOH hấp thụ được khí Cl2.
Phương trình hóa học:
2NaOH + Cl2 → NaCl + NaClO + H2O
Câu 5 trang 118 Hóa học 10
Làm muối là nghề phổ biến tại nhiều vùng ven biển Việt Nam. Một hộ gia đình tiến hành làm muối trên ruộng muối chứa 200 000 L nước biển. Giả thiết 1 L nước biển có chứa 30 g NaCl và hiệu suất quá trình làm muối thành phẩm đạt 60%.
Khối lượng muối hộ gia đình thu được là
A. 1 200 kg.
B. 10 000 kg.
C. 6 000 kg.
D. 3 600 kg.
Lời giải:
Đáp án đúng là: D
Ta có, 1 L nước biển chứa 30 g NaCl.
⇒ 200 000 L nước biển chứa 200000×30/1 = 6000000g NaCl = 6000kg NaCl
Do hiệu suất quá trình làm muối thành phẩm đạt 60% nên khối lượng muối hộ gia đình thu được là 6000×60/100=3600 kg
Câu 6 trang 118 Hóa học 10
Cho X, Y là hai nguyên tố halogen có trong tự nhiên, ở hai chu kì liên tiếp, Zx < ZY. Hoà tan hoàn toàn 0,402 g hỗn hợp NaX và NaY vào nước, thu được dung dịch E. Cho từ từ E vào cốc đựng dung dịch AgNO3 dư, thu được 0,574 g kết tủa.
Kí hiệu của nguyên tố X và Y lần lượt là
A. F và Cl.
B. Cl và Br.
C. Br và I.
D. Cl và I.
Lời giải:
Đáp án đúng là: A
Xét TH1. X là Flo, Y là clo.
NaF + AgNO3 không phản ứng
NaCl + AgNO3 → AgCl↓ + NaNO3
⇒ nAgCl = 0,574/413,5 = 0,004 mol
⇒ nNaCl = nAgCl = 0,004 mol
⇒ mNaCl = 0,004.58,5 = 0,234 < 0,402
⇒ TH1 thỏa mãn.
Do bài trắc nghiệm, trường hợp 1 đã thỏa mãn nên không cần xét tiếp trường hợp 2 là X khác F.
Trắc nghiệm Hóa 10 Kết nối tri thức Bài 23 (có đáp án)
Câu 1. Trong các halogen, halogen nào ở trạng thái lỏng trong điều kiện thường?
A. Chlorine;
B. Bromine;
C. Iodine;
D. Fluorine.
Lời giải
Đáp án đúng là: B
Trong điều kiện thường, fluorine và chlorine ở trạng thái khí, bromine ở trạng thái lỏng và iodine ở trạng thái rắn.
Câu 2. Tính oxi hoá của các halogen tăng dần theo thứ tự nào sau đây?
A. Cl2, F2, Br2, I2;
B. F2, Cl2, Br2, I2;
C. I2, Br2, Cl2, F2;
D. I2, Cl2, Br2, F2.
Lời giải
Đáp án đúng là: C
Tính oxi hoá của các halogen tăng dần từ I2 đến F2.
Câu 3. Một nguyên tố halogen có lớp electron ngoài cùng là 3s23px. Nguyên tố đó là:
A. F (Z = 9);
B. Cl (Z = 17);
C. Br (Z = 35);
D. Chưa biết.
Lời giải
Đáp án đúng là: B
Một nguyên tố halogen có lớp electron ngoài cùng là 3s23px
Nguyên tố halogen thuộc chu kì 3
Nguyên tố đó là Cl (Z =17).
Câu 4. Phản ứng của H2 và Cl2 xảy ra trong điều kiện nào?
A. Ở nhiệt độ phòng và trong bóng tối;
B. Ánh sáng hoặc to;
C. 200oC, xúc tác Pt;
D. 300oC, xúc tác Pt.
Lời giải
Đáp án đúng là: B
Phản ứng của H2 và F2 xảy ra ngay ở nhiệt độ phòng và trong bóng tối.
Phản ứng của H2 và Cl2 xảy ra khi có ánh sáng hoặc to.
Phản ứng của H2 và Br2 xảy ra ở khoảng 200oC, xúc tác Pt.
Phản ứng của H2 và I2 xảy ra ở khoảng 300oC, xúc tác Pt.
Câu 5. Acid có tính khử mạnh nhất là?
A. HF;
B. HCl;
C. HBr;
D. HI.
Lời giải
Đáp án đúng là: D
Thứ tự sắp xếp tính khử giảm dần là: HI > HBr > HCl > HF.
Câu 6. Phát biểu nào sau đây không đúng?
A. Trong tự nhiên các halogen tồn tại ở dạng đơn chất;
B. Độ âm điện giảm dần từ F, Cl, Br, I;
C. Muối AgF tan, còn AgCl, AgBr, AgI, không tan trong H2O;
D. Các hydrogen halide đều là chất khí, dung dịch của chúng đều có tính acid.
Lời giải
Đáp án đúng là: A
Trong tự nhiên các halogen chỉ tồn tại ở dạng hợp chất.
Câu 7. Trong các chất sau, chất thường dùng để khử trùng nước sinh hoạt là
A. N2
B. O2
C. CO2
D. Cl2
Lời giải
Đáp án đúng là: D
Chất thường dùng để khử trùng nước sinh hoạt là Cl2.
Câu 8. Thực hiện các thí nghiệm sau:
(a) Cho dung dịch NaCl vào dung dịch KOH.
(b) Cho dung dịch Na2CO3 vào dung dịch Ca(OH)2.
(c) Điện phân dung dịch NaCl với điện cực trơ, có màng ngăn.
(d) Cho Cu(OH)2 vào dung dịch NaNO3.
(e) Cho dung dịch Na2SO4 vào dung dịch Ba(OH)2.
Số các thí nghiệm đều sinh ra NaOH là:
A. 1;
B. 2;
C. 3;
D. 4.
Lời giải
Đáp án đúng là: C
Các thí nghiệm đều điều chế được NaOH là: (b), (c), (e).
(b) Na2CO3 + Ca(OH)2 → CaCO3↓ + 2NaOH
(c) 2NaCl+2H2O→2NaOH+H2+Cl2
(e) Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4↓
Câu 9. Cho các phản ứng sau:
(a) 4HCl + PbO2 -®- PbCl2 + Cl2 + 2H2O
(b) HCl + NH4HCO3® NH4Cl + CO2 + H2O
(c) 2HCl + 2HNO3 ® 2NO2 + Cl2 + 2H2O
(d) 2HCl + Zn ® ZnCl2 + H2
Số phản ứng trong đó HCl thể hiện tính khử là
A. 2;
B. 4;
C. 1;
D. 3.
Lời giải
Đáp án đúng là: A
Phản ứng trong đó HCl thể hiện tính khử là: (a), (c)
Do số oxi hóa của Cl từ -1 lên 0.
Câu 10. Dung dịch HCl tác dụng với các chất trong dãy nào sau đây?
A. MnO2; Fe3O4; NaHS; FeS;
B. KMnO4; Na2O; CH3COOH; CuS;
C. Fe; Ag2O; KHCO3; S;
D. PbO2; CuO; SO2; Na2S.
Lời giải
Đáp án đúng là: A
Loại B vì CH3COOH, CuS không phản ứng;
Loại C vì S không phản ứng;
Loại D vì SO2 không phản ứng.
Câu 11. Để sản xuất F2 trong công nghiệp, người ta điện phân hỗn hợp:
A. CaF2 + 2HF nóng chảy;
B. 3NaF + AlF3 nóng chảy;
C. KF + 3HF nóng chảy;
D. AlF3 + 3HF nóng chảy.
Lời giải
Đáp án đúng là: C
Trong công nghiệp, hỗn hợp gồm KF và HF được dùng để điện phân nóng chảy sản xuất fluorine theo tỉ lệ mol là 1:3.
Câu 12. Khi đun nóng, iodine rắn biến thành hơi, không qua trạng thái lỏng. Hiện tượng này được gọi là
A. Sự chuyển trạng thái;
B. Sự bay hơi;
C. Sự thăng hoa;
D. Sự phân hủy.
Lời giải
Đáp án đúng là: C
Ở nhiệt độ cao, iodine thăng hoa, chuyển từ thể rắn sang thể hơi mà không qua thể lỏng.
Câu 13. Sục một lượng khí clo vào dung dịch hỗn hợp (NaI + NaBr) thì chất được giải phóng ra trước là
A. I2;
B. Br2 ;
C. Cl2 và Br2;
D. I2 và Br2.
Lời giải
Đáp án đúng là: A
Iodine có tính oxi hóa kém hơn bromine nên chlorine oxi hóa muối sodium iodide thành iodine trước:
Cl2 + 2NaI → 2NaCl + I2
Câu 14. Đốt cháy hoàn toàn 28 gam bột sắt trong khí clo dư. Khối lượng muối clorua sinh ra là
A. 32,50 gam
B. 24,50 gam
C. 81,25 gam
D. 25,40 gam
Lời giải
Đáp án đúng là: C
nFe = 28/56 = 0,5(mol)
2Fe+3Cl2→2FeCl3
⇒nFeCl3 = 0,5(mol)
⇒mFeCl3 = 0,5.162,5 = 81,25 gam
Câu 15. Hòa tan hoàn toàn 86,7 gam hỗn hợp X gồm NaCl và NaI vào nước được dung dịch Y. Sục khí Cl2 dư vào Y, sau khi kết thúc phản ứng, cô cạn dung dịch thu được 40,95 gam muối khan. Khối lượng của NaCl có trong X là?
A. 29,5 gam
B. 58,5 gam
C. 11,7gam
D. 23,4 gam
Lời giải
Đáp án đúng là: C
Gọi x, y lần lượt là số mol của NaCl và NaI trong hỗn hợp X.
⇒ 58,5x + 150y = 86,7 (1)
Cl2 + 2NaI → 2NaCl + I2
⇒ nNaCl = y (mol)
nmuối khan = nNaCl = ( mol)
⇒ x + y = 0,7 (2)
Từ (1) và (2) ta có hệ phương trình:
58,5x + 150y = 86,7 và x + y = 0,7 <=> x=0,2 và y=0,5
=> mNaCl = 0,2.58,5 = 11,7 gam.
******************
Trên đây là nội dung bài học Hóa học 10 Kết nối tri thức Bài 23: Ôn tập chương 7 do THPT Ngô Thì Nhậm biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Ôn tập chương 7. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường THPT Ngô Thì Nhậm
Chuyên mục: Hoá học 10