Hóa học 10 Kết nối tri thức Bài 13: Liên kết hydrogen và tương tác van der Waals được THPT Ngô Thì Nhậm biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 10 Kết nối tri thức Bài 13
I. Giới thiệu chung
– Tính chất vật lí của các chất có liên kết cộng hóa trị được quyết định bởi lực tương tác giữa các phân tử, hình dạng của phân tử và mức độ phân cực của liên kết cộng hóa trị trong phân tử.
Ví dụ: Bong bóng xà phòng thể hiện tương tác giữa các phân tử nước và các phân tử xà phòng tạo thành màng mỏng, giữ được không khí bên trong để bay lên.
– Lực tương tác giữa các phân tử yếu hơn rất nhiều so với lực liên kết ion, liên kết cộng hóa trị hay liên kết kim loại.
– Một số tương tác điển hình giữa các phân tử là liên kết hydrogen và tương tác van der Waals.
II. Liên kết hydrogen
1. Bản chất của liên kết hydrogen
– Liên kết hydrogen là một loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng.
– Liên kết hydrogen thường được kí hiệu là dấu ba chấm (…), rải đều từ nguyên tử H đến nguyên tử tạo liên kết hydrogen với nó.
– Điều kiện cần và đủ để tạo thành liên kết hydrogen:
+ Nguyên tử hydrogen liên kết với các nguyên tử có độ âm điện lớn như F, O, N …
+ Nguyên tử F, O, N, … liên kết với hydrogen phải có ít nhất một cặp electron hóa trị chưa liên kết.
– Một số kiểu tạo thành liên kết hydrogen:
2. Vai trò và ảnh hưởng của liên kết hydrogen đến tính chất vật lí của nước
Liên kết hydrogen làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của nước.
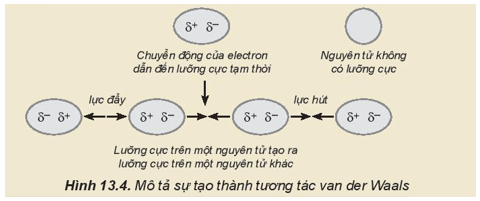
II. Tương tác van der Waals
1. Khái niệm tương tác van der Waals
– Tương tác van der Waals là tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử hay phân tử.
– Sự hình thành tương tác van der Waals:
+ Tương tác van der Waals thể hiện rõ ở các chất cộng hóa trị phân cực do chúng có cấu tạo lưỡng cực, một đầu mang một phần điện tích âm và một đầu mang một phần điện tích dương.
+ Các nguyên tử khí hiếm hoặc các chất cộng hóa trị không phân cực, do đám mây electron luôn chuyển động nên cũng có thể tạo ra một lưỡng cực tạm thời. Lực hút giữa một đầu mang một phần điện tích âm (δ-) của lưỡng cực trong phân tử này và một đầu mang một phần điện tích dương (δ+) của lưỡng cực trong phân tử khác tạo thành tương tác van der Waals.
2. Ảnh hưởng của tương tác van der Waals đến nhiệt độ nóng chảy, nhiệt độ sôi của các chất
– Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi các chất.
+ Ví dụ 1: Trong dãy halogen, tương tác van der Waals tăng theo sự tăng của số electron (và proton) trong phân tử, làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của các chất.
+ Ví dụ 2: Pentane là hydrocarbon no có công thức C5H12. Đồng phân mạch không phân nhánh pantane có nhiệt độ sôi (36oC) cao hơn so với đồng phân mạch nhánh neopentane (9,5oC) do diện tích tiếp xúc giữa các phân tử pentane lớn hơn nhiều so với neopentane.
Giải bài tập SGK Hóa học 10 Kết nối tri thức Bài 13
Mở đầu trang 64 Hóa học 10
Ở áp suất khí quyển, nhiệt độ sôi của H2O là 100oC, CH4 là -161,58oC, H2S là -60,28oC. Vì sao các chất trên có nhiệt độ sôi khác nhau?
Lời giải:
– Các chất trên đều là hợp chất cộng hóa trị phân cực.
– Các tính chất vật lí của các chất có liên kết cộng hóa trị được quyết định bởi lực tương tác giữa các phân tử, hình dạng phân tử và mức độ phân cực của liên kết.
⇒ Các chất khác nhau có nhiệt độ sôi khác nhau.
Câu hỏi 1 trang 66 Hóa học 10
Vẽ sơ đồ biểu diễn liên kết hydrogen giữa:
a) hai phân tử hydrogen fluoride (HF).
b) phân tử hydrogen fluoride (HF) và phân tử ammonia (NH3).
Lời giải:
a) H – F … H – F.
b)
Câu hỏi 2 trang 66 Hóa học 10
Những nguyên tử hydrogen nào trong phân tử ethanol (CH3CH2OH) không tham gia vào liên kết hydrogen? Vì sao?
Lời giải:
Những nguyên tử H không gắn nguyên tử O thì không tham gia vào liên kết hydrogen.
Vì để tham gia vào liên kết hydrogen, nguyên tử hydrogen phải liên kết với các nguyên tử có độ âm điện lớn như F, O, N, … và các nguyên tử này phải có ít nhất 1 cặp electron hóa trị chưa tham gia liên kết.
⇒ Chỉ có nguyên tử H gắn vào O trong ethanol tham gia vào liên kết hydrogen.
Câu hỏi 3 trang 67 Hóa học 10
Hãy giải thích sự khác nhau về nhiệt độ sôi của butane và isobutane.
Lời giải:
Butane và isobutane là hợp chất cộng hóa trị không phân cực và có cùng công thức phân tử là C4H10. Đồng phân butane có nhiệt độ sôi cao hơn isobutane vì diện tích tiếp xúc của các phân tử butane lớn hơn so isobutane.
⇒ Năng lượng để phá vỡ lực liên phân tử giữa các phân tử butane cần nhiều hơn isobutane nên có nhiệt độ sôi cao hơn.
Em có thể trang 67 Hóa học 10
So sánh được tính chất vật lí giữa các phân tử dựa vào liên kết hydrogen và tương tác van der Waals.
Lời giải:
Để so sánh được tính chất vật lí giữa các phân tử, chúng ta cần nắm được những ý sau:
– Liên kết hydrogen được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị chưa tham gia liên kết.
⇒ Liên kết hydrogen làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của nước.
– Tương tác van der Waals là tương tác tĩnh điện lưỡng cực – lưỡng cực được hình thành giữa các phân tử hay nguyên tử.
⇒ Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
Trắc nghiệm Hóa 10 Kết nối tri thức Bài 13 (có đáp án)
Câu 1. Các tính chất vật lý của các chất có liên kết cộng hóa trị được quyết định bởi các yếu tố nào?
A. Lực tương tác giữa các phân tử;
B. Hình dạng của phân tử;
C. Mức độ phân cực của liên kết cộng hóa trị trong phân tử;
D. Cả A, B, C đều đúng.
Lời giải
Đáp án đúng là: D
Các tính chất vật lý của các chất có liên kết cộng hóa trị được quyết định bởi lực tương tác giữa các phân tử, hình dạng của phân tử và mức độ phân cực của liên kết cộng hóa trị trong phân tử.
Câu 2. Liên kết hydrogen được hình thành như thế nào?
A. Giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị chưa tham gia vào liên kết;
B. Giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn);
C. Giữa nguyên tử H và nguyên tử O;
D. Giữa nguyên tử H và các phi kim.
Lời giải
Đáp án đúng là: A
Liên kết hydrogen được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị chưa tham gia vào liên kết.
Câu 3. Liên kết hydrogen có tính chất nào sau đây?
A. Không bền bằng liên kết ion;
B. Không bền bằng liên kết cộng hóa trị;
C. Không bền bằng liên kết cho – nhận;
D. Tất cả các tính chất A, B, C đều đúng.
Lời giải
Đáp án đúng là: D
Lực tương tác giữa các phân tử yếu hơn rất nhiều so với lực liên kết ion, liên kết cộng hóa trị hay liên kết kim loại.
Câu 4. Nguyên nhân làm cho các liên kết phân cực là?
A. Sự chênh lệch độ âm điện lớn;
B. Sự chênh lệch năng lượng liên kết;
C. Do liên kết hidro trong phân tử;
D. Do bán kính của nguyên tử.
Lời giải
Đáp án đúng là: A
Sự chênh lệch độ âm điện lớn làm cho các liên kết phân cực, cặp electron dùng chung trong liên kết cộng hóa trị bị hút lệch về phía các nguyên tử có độ âm điện lớn hơn.
Câu 5. Liên kết hydrogen có thể xuất hiện giữa những phân tử cùng loại nào sau đây?
A. C2H6
B. H2S
C. H3C-O-CH3
D. NH3
Lời giải
Đáp án đúng là: D
A. Loại vì C-H là liên kết cộng hóa trị không phân cực, nguyên tử C không còn electron hóa trị riêng.
B. Loại vì S-H là liên kết cộng hóa trị không phân cực.
C. Loại vì trong phân tử H3C-O-CH3 nguyên tử C và O đều không có cặp electron hóa trị riêng.
D. Chọn vì liên kết N-H phân cực. Liên kết hydrogen giữa hai phân tử NH3 được biểu diễn như sau:
Câu 6. Số phát biểu sai về sự tạo thành liên kết hydrogen?
(1) Nguyên tử hydrogen liên kết với các nguyên tử có độ âm điện lớn như F, O, N,…;
(2) Nguyên tử liên kết với hydrogen phải có ít nhất một cặp electron hóa trị chưa liên kết;
(3) Nguyên tử hydrogen liên kết với các nguyên tử thuộc nhóm kim loại kiềm và kiềm thổ;
(4) Nguyên tử liên kết với hydrogen phải có cấu hình electron bền vững.
A. 1;
B. 2;
C. 3;
D. 4.
Lời giải
Đáp án đúng là: B
Phát biểu sai: (3), (4).
Câu 7. Liên kết hydrogen có ảnh hưởng như thế nào tới tính chất vật lý của nước?
A. Không có ảnh hưởng gì;
B. Làm tăng nhiệt độ nóng chảy;
C. Làm tăng nhiệt độ sôi;
D. Cả B và C đều đúng
Lời giải
Đáp án đúng là: D
Liên kết hydrogen làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của nước.
Câu 8. Tương tác van der Waals là gì?
A. Là tương tác tĩnh điện giữa các phân tử;
B. Là tương tác tĩnh điện lưỡng cực – lưỡng cực các nguyên tử hay phân tử;
C. Là tương tác giữa các electron trong phân tử;
D. Là tương tác giữa các electron hóa trị trong phân tử.
Lời giải
Đáp án đúng là: B
Tương tác van der Waals là tương tác tĩnh điện lưỡng cực – lưỡng cực các nguyên tử hay phân tử.
Câu 9. Tương tác van der Waal có ảnh hưởng gì đến nhiệt độ nóng chảy và nhiệt độ sôi của các chất?
A. Không có ảnh hưởng gì;
B. Làm tăng nhiệt độ nóng chảy;
C. Làm tăng nhiệt độ sôi;
D. Cả B và C đều đúng
Lời giải
Đáp án đúng là: D
Tương tác van der Waal làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
Câu 10. Khi khối lượng phân tử tăng thì tương tác van der Waals như thế nào?
A. Giảm;
B. Tăng;
C. Tăng rồi giảm;
D. Giảm rồi tăng.
Lời giải
Đáp án đúng là: B
Khi khối lượng phân tử tăng thì tương tác van der Waals tăng.
Câu 11. Tại sao ở nhiệt độ phòng fluorine, chlorine là những chất khí, còn bromine là chất lỏng?
A. Do giữa các phân tử bromine có tương tác van der Waals;
B. Do độ âm điện của bromine thấp hơn fluorine, chlorine;
C. Do năng lượng liên kết của bromine lớn hơn fluorine, chlorine;
D. Do bán kính nguyên tử bromine lớn hơn fluorine, chlorine.
Lời giải
Đáp án đúng là: A
Cùng là phân tử không phân cực, ở nhiệt độ phòng, fluorine, chlorine là những chất khí, còn bromine là chất lỏng. Như vậy, ở trạng thái lỏng, các phân tử bromine tồn tại một tương tác yếu. Tương tác yếu đó gọi là tương tác van der Waals.
Câu 12. Nhiệt độ nóng chảy của các phân tử trong dãy halogen được sắp xếp theo thứ tự tăng dần là?
A. Cl2, Br2, F2, I2;
B. I2, Br2, Cl2, F2;
C. F2, Cl2, Br2, I2;
D. F2, Br2, Cl2, I2-.
Lời giải
Đáp án đúng là: C
Trong dãy halogen, tương tác van der Waals tăng theo sự tăng của số electron và proton trong phân tử, làm tăng nhiệt độ nóng chảy của các chất.
Câu 13. Liên kết hydrogen thường được biểu diễn như thế nào?
A. Biểu diễn bằng dấu ba chấm giữa các nguyên tử;
B. Biểu diễn bằng liên kết đôi giữa các nguyên tử;
C. Biểu diễn bằng liên kết ba giữa các nguyên tử;
D. Biểu diễn bằng mũi tên giữa các nguyên tử.
Lời giải
Đáp án đúng là: A
Liên kết hydrogen thường được biểu diễn bằng dấu ba chấm giữa các nguyên tử.
Câu 14. Nhiệt độ sôi của H2O cao hơn nhiều so với H2S và CH4 vì?
A. Nhiệt độ nóng chảy cao làm cho nhiệt độ sôi cao.
B. Liên kết O-H phân cực hơn liên kết S-H và C-H nên phân tử H2O khó bị phá vỡ hơn.
C. H2O là dung môi hòa tan được nhiều chất.
D. Giữa các phân tử nước có liên kết hydrogen còn H2S và CH4 thì không.
Lời giải
Đáp án đúng là: D
Giữa các phân tử nước có liên kết hydrogen còn H2S và CH4 thì không.
Liên kết hydrogen làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của nước.
Câu 15. Tại sao khi chưng cất rượu, C2H5OH bay hơi trước H2O mà C2H5OH có khối lượng phân tử lớn hơn H2O?
A. Các phân tử nước liên kết chặt chẽ với nhau bằng liên kết hydrogen;
B. Nhiệt độ sôi của H2O cao hơn C2H5OH;
C. Khi chưng cất, C2H5OH ở điểm sôi thấp hơn nên bay hơi trước;
D. Cả A, B, C đều đúng.
Lời giải
Đáp án đúng là: D
Mặc dù C2H5OH có khối lượng phân tử lớn hơn H2O nhưng các phân tử nước liên kết chặt chẽ với nhau bằng liên kết hydrogen
Nhiệt độ sôi của H2O cao hơn C2H5OH.
Khi chưng cất, C2H5OH ở điểm sôi thấp hơn nên bay hơi trước.
******************
Trên đây là nội dung bài học Hóa học 10 Kết nối tri thức Bài 13: Liên kết hydrogen và tương tác van der Waals do THPT Ngô Thì Nhậm biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Liên kết hydrogen và tương tác van der Waals. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường THPT Ngô Thì Nhậm
Chuyên mục: Hoá học 10