Hóa học 10 Kết nối tri thức Bài 20: Ôn tập chương 6 được THPT Ngô Thì Nhậm biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 10 Kết nối tri thức Bài 20
Tốc độ phản ứng
Xét phản ứng hoá học dạng tổng quát: aA + bB → cC + dD.
Biểu thức tốc độ trung bình của phản ứng
Nếu phản ứng trên là một phản ứng đơn giản thì biểu thức tốc độ phản ứng theo hằng số tốc độ phản ứng: v = k.
Các yếu tố ảnh hưởng đến tốc độ phản ứng
+ Nồng độ
+ Áp suất
+ Nhiệt độ
+ Diện tích tiếp xúc
⇒ Khi tăng các yếu tố này làm tăng số va chạm hiệu quả, dẫn đến tốc độ phản ứng tăng.
+ Chất xúc tác: Khi có chất này, năng lượng hoạt hoá giảm dẫn đến tốc độ phản ứng tăng.
Giải bài tập SGK Hóa học 10 Kết nối tri thức Bài 20
Câu 1 trang 102 Hóa học 10
Hãy cho biết trong các phản ứng sau, phản ứng nào có tốc độ nhanh, phản ứng nào có tốc độ chậm?
(a) Đốt cháy nhiên liệu.
(b) Sắt bị gỉ.
(c) Trung hoà acid – base.
Lời giải:
(a) Đốt cháy nhiên liệu: xảy ra với tốc độ nhanh.
(b) Sắt bị gỉ: xảy ra với tốc độ chậm.
(c) Trung hòa acid – base: xảy ra với tốc độ nhanh.
Câu 2 trang 102 Hóa học 10
Cho khoảng 2 g zinc (kẽm) dạng hạt vào một cốc đựng dung dịch H2SO4 2 M (dư) ở nhiệt độ phòng. Nếu chỉ biến đổi một trong các điều kiện sau đây (các điều kiện khác giữ nguyên) thì tốc độ phản ứng sẽ thay đổi thế nào (tăng lên, giảm xuống hay không đổi)?
(a) Thay kẽm hạt bằng kẽm bột cùng khối lượng và khuấy đều.
(b) Thay dung dịch H2SO4 2 M bằng dung dịch H2SO4 1 M có cùng thể tích.
(c) Thực hiện phản ứng ở nhiệt độ cao hơn (khoảng 50 °C).
Lời giải:
(a) Khi thay kẽm hạt bằng kẽm bột cùng khối lượng và khuấy đều thì tốc độ phản ứng tăng lên do tăng diện tích tiếp xúc của Zn.
(b) Khi thay dung dịch H2SO4 2 M bằng dung dịch H2SO4 1 M có cùng thể tích thì tốc độ phản ứng giảm do nồng độ acid giảm.
(c) Khi thực hiện phản ứng ở nhiệt độ cao hơn (khoảng 50 °C) thì tốc độ phản ứng tăng lên do số lần va chạm hiệu quả tăng.
Câu 3 trang 102 Hóa học 10
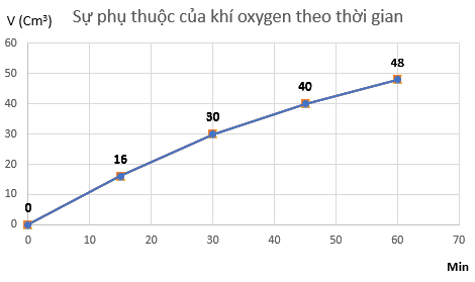
Hydrogen peroxide phân huỷ theo phản ứng: 2H2O2 → 2H2O + O2.
Đo thể tích oxygen thu được theo thời gian, kết quả được ghi trong bảng sau:
Thời gian (min) 0 15 30 45 60 Thể tích khí oxygen (cm3) 0 16 30 40 48
a) Vẽ đồ thị mô tả sự phụ thuộc của thể tích khí oxygen theo thời gian.
b) Tính tốc độ trung bình của phản ứng (theo cm3/min) trong các khoảng thời gian:
– Từ 0 ÷ 15 phút;
– Từ 15 ÷ 30 phút;
– Từ 30 ÷ 45 phút;
– Từ 45 ÷ 60 phút.
Nhận xét sự thay đổi tốc độ trung bình theo thời gian.
Lời giải:
a) Đồ thị mô tả sự phụ thuộc của thể tích khí oxygen theo thời gian
b) Tốc độ trung bình của phản ứng từ 0 ÷ 15 phút là:
vtb=1,067 cm3/min
Tốc độ trung bình của phản ứng từ 15 ÷ 30 phút là:
vtb=0,933 cm3/min
Tốc độ trung bình của phản ứng từ 30 ÷ 45 phút là:
vtb=0,667 cm3/min
Tốc độ trung bình của phản ứng từ 45 ÷ 60 phút là:
vtb=0,533 cm3/min
⇒ Tốc độ trung bình giảm dần theo thời gian.
Câu 4 trang 102 Hóa học 10
Hãy thiết kế một thí nghiệm để chứng minh ảnh hưởng của nhiệt độ đến tốc độ phản ứng của zinc và sulfuric acid loãng.
Lời giải:
Chuẩn bị: Zn dạng viên, quỳ tím, sulfuric acid loãng, 2 ống nghiệm, đèn cồn, kẹp gỗ.
Tiến hành:
– Cho vào mỗi ống nghiệm khoảng 3 mL sulfuric acid loãng.
– Cho vào mỗi ống nghiệm mẩu quỳ tím và cho vào mỗi ống 1 viên Zn.
– Đun nóng 1 ống nghiệm.
Lưu ý: Làm sạch bề mặt Zn trước khi tiến hành thí nghiệm.
Hiện tượng:
– Ban đầu, khi cho quỳ tím vào 2 ống nghiệm thì quỳ tím chuyển sang màu đỏ.
– Ống nghiệm bị đun nóng thì quỳ tím nhạt màu nhanh chóng.
Phương trình hóa học:
Zn + 2HCl → ZnCl2 + H2
Câu 5 trang 102 Hóa học 10
Một phản ứng ở 45 °C có tốc độ là 0,068 mol/(L.min). Hỏi phải giảm xuống nhiệt độ bao nhiêu để tốc độ phản ứng là 0,017 mol/(L.min). Giả sử, trong khoảng nhiệt độ thí nghiệm, hệ số nhiệt độ Van’t Hoff của phản ứng bằng 2.
Lời giải:
Mở rộng: a = 2
⇒ T = 45 – 10.2 = 25 oC
⇒ Vậy phải giảm xuống đến 25 oC thì tốc độ phản ứng là 0,017 mol/(L.min)
Trắc nghiệm Hóa 10 Kết nối tri thức Bài 20 (có đáp án)
Câu 1. Yếu tố nào không dùng để đánh giá mức độ xảy ra phản ứng nhanh hay chậm của các phản ứng hóa học?
A. Nhiệt độ;
B. Nồng độ;
C. Thể tích khí;
D. Diện tích bề mặt chất rắn
Lời giải
Đáp án đúng là: C
Có 5 yếu tố ảnh hưởng đến tốc độ phản ứng:
– Nồng độ
– Áp suất
– Nhiệt độ
– Diện tích bề mặt tiếp xúc của chất
– Chất xúc tác
Câu 2. Nhận định nào dưới đây là đúng?
A. Nồng độ chất phản ứng tăng thì tốc độ phản ứng tăng;
B. Sự thay đổi nồng độ chất phản ứng không ảnh hưởng đến tốc độ phản ứng;
C. Nồng độ chất phản ứng giảm thì tốc độ phản ứng tăng;
D. Nồng độ chất phản ứng tăng thì tốc độ phản ứng giảm.
Lời giải
Đáp án đúng là: A
Khi nồng độ chất phản ứng tăng lên, số va chạm giữa các hạt tăng lên, làm số va chạm hiệu quả của tăng lên và dẫn đến tốc độ phản ứng tăng.
Câu 3. Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng:
CaCO3 →CaO + CO2
A. Nhiệt độ
B. Kích thước của các hạt CaCO3.
C. Áp suất;
D. Kích thước của các hạt CaO.
Lời giải
Đáp án đúng là: D
Kích thước của CaO không ảnh hưởng đến tốc độ phản ứng.
Câu 4. Cho phương trình hóa học: X2(k) + Y2 (k) → 2XY(k). Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng?
A. Nhiệt độ;
B. Áp suất;
C. Nồng độ;
D. Chất xúc tác.
Lời giải
Đáp án đúng là: B
Với phản ứng có tổng số mol khí ở hai vế bằng nhau, việc thay đổi áp suất không làm ảnh hưởng đến tốc độ phản ứng.
Câu 5. Cho phản ứng: N2 + 3H2 t°⇄°2NH3
Tốc độ phản ứng thay đổi thế nào khi giảm nồng độ của khí H2 đi 3 lần?
A. Tăng 3 lần;
B. Giảm 3 lần;
C. Tăng 9 lần;
D. Giảm 9 lần.
Lời giải
Đáp án đúng là: D
Khi giảm nồng độ của khí H2 đi 3 lần thì tốc độ phản ứng giảm đi 9 lần.
Câu 6. Khi tăng nhiệt độ từ 50oC đến 90oC thì tốc độ phản ứng tăng lên bao nhiêu lần, biết rằng sau khi tăng nhiệt độ lên 10oC thì tốc độ phản ứng tăng lên 2 lần.
A. 2;
B. 4;
C. 8;
D. 16.
Lời giải
Đáp án đúng là: D
Ta có: (90−50)/10=4
Tốc độ phản ứng tăng 24 = 16 lần
Câu 7. Khi áp suất tăng làm cho tốc độ phản ứng tăng là đúng với phản ứng có chất nào tham gia?
A. Chất lỏng;
B. Chất rắn;
C. Chất khí;
D. Cả ba đều đúng.
Lời giải
Đáp án đúng là: C
Việc thay đổi áp suất không làm ảnh hưởng đến tốc độ của phản ứng không có chất khí tham gia.
Câu 8. Khi bắt đầu phản ứng, nồng độ của chất X là 0,012 mol/l. Sau 20 giây xảy ra phản ứng, nồng độ của chất đó là 0,01 mol/l. Tốc độ phản ứng trung bình là?
A. 10-2;
B. 10-3;
C. 10-4;
D. 10-5.
Lời giải
Đáp án đúng là: C
Câu 9. Cách nào sau đây không làm tăng diện tích bề mặt của chất rắn?
A. Đập nhỏ hạt;
B. Nghiền nhỏ hạt;
C. Tạo nhiều đường rãnh, lỗ;
D. Hòa tan chất rắn trong acid.
Lời giải
Đáp án đúng là: D
Hòa tan chất rắn trong acid không làm tăng diện tích bề mặt của chất rắn.
Câu 10. Yếu tố nào liên quan đến sự ảnh hưởng của xúc tác với tốc độ phản ứng?
A. Năng lượng ion hóa;
B. Năng lượng liên kết;
C. Năng lượng hoạt hóa;
D. Năng lượng phá vỡ liên kết.
Lời giải
Đáp án đúng là: C
Ảnh hưởng của chất xúc tác đến tốc độ phản ứng được giải thích dựa vào năng lượng hoạt hóa.
Khi có xúc tác, phản ứng sẽ xảy ra qua nhiều giai đoạn. Mỗi giai đoạn đều có năng lượng hoạt hóa thấp hơn so với phản ứng không xúc tác. Do đó số hạt có đủ năng lượng hoạt hóa sẽ nhiều hơn, dẫn đến tốc độ phản ứng tăng lên.
Câu 11. Cho 5,6 gam iron dạng hạt vào một cốc đựng dung dịch HCl 1M (dư). Cách nào sau đây là tăng tốc độ phản ứng trên?
A. Thay iron dạng hạt bằng iron dạng bột cùng khối lượng;
B. Thay dung dịch HCl 1M bằng dung dịch HCl 0,5M;
C. Thay dung dịch HCl 1M bằng dung dịch HCl 0,25M;
D. Thực hiện phản ứng ở nhiệt độ 0oC.
Lời giải
Đáp án đúng là: A
Thay iron dạng hạt bằng iron dạng bột cùng khối lượng làm tăng diện tích tiếp xúc bề mặt dẫn đến tốc độ phản ứng tăng.
Câu 12. Phát biểu nào sau đây sai?
A. Tốc độ phản ứng đặc trưng cho sự nhanh chậm của một phản ứng hóa học;
B. Khi nồng độ chất tan trong dung dịch tăng, tốc độ phản ứng giảm;
C. Khi nhiệt độ phản ứng tăng, tốc độ phản ứng tăng;
D. Chất xúc tác làm tăng tốc độ phản ứng nhưng không bị biến đổi về lượng và chất sau phản ứng.
Lời giải
Đáp án đúng là: B
Khi nồng độ chất tan trong dung dịch tăng, tốc độ phản ứng tăng.
Câu 13. Tại sao nhiều phản ứng hóa học trong công nghiệp cần tiến hành ở nhiệt độ cao và sử dụng chất xúc tác?
A. Ở nhiệt độ thường, tốc độ phản ứng xảy ra rất chậm nên cần thêm xúc tác và tăng nhiệt độ để tốc độ phản ứng xảy ra nhanh hơn;
B. Thêm xúc tác để tạo ra nhiều sản phẩm hơn;
C. Tăng nhiệt độ để các chất trộn đều vào nhau;
D. Giúp hiệu suất phản ứng đạt mức tối đa
Lời giải
Đáp án đúng là: A
Do trong công nghiệp cần sản xuất các chất với một lượng lớn, thời gian sản xuất nhanh để đạt hiệu quả kinh tế nên nên cần tốc độ phản ứng nhanh.
Ở nhiệt độ thường, tốc độ các phản ứng xảy ra chậm nên cần thêm xúc tác và tăng nhiệt độ để tốc độ phản ứng xảy ra nhanh hơn.
Câu 14. Cho phản ứng: A2 + B2 → 2AB
Biết nồng độ của chất A và chất B lần lượt là 0,2M và 0,3M. Hằng số tốc độ phản ứng là 0,8. Tốc độ phản ứng tại thời điểm ban đầu là?
A. 0,012;
B. 0,024;
C. 0,036;
D. 0,048
Lời giải
Đáp án đúng là: D
v=k.CA.CB=0,8.0,2.0,3=0,048 (mol/L.s)
Câu 15. Cho phản ứng: 2NO+O2→2NO
Biết nồng độ của khí NO là 0,5M và khí O2 là 0,2M. Hằng số tốc độ phản ứng là 0,3. Tốc độ phản ứng khi nồng độ khí NO giảm đi 0,2M là?
A. 2,7.10-3;
B. 1,2.10-4;
C. 5,4.10-4;
D. 10-4.
Lời giải
Đáp án đúng là: A
2NO+O2to→2NO2
Theo tỉ lệ phản ứng, khi nồng độ khí NO giảm đi 0,2M thì nồng độ khí O2 giảm đi 0,1M.
⇒⇒Nồng độ còn lại của khí NO là: 0,5 – 0,2 = 0,3M
Nồng độ còn lại của khí O2 là: 0,2 – 0,1 = 0,1M
Tốc độ phản ứng: v=k.C2NO2.CO2=0,3.0.32.0,1=2,7.10−3 (mol/L.s)
******************
Trên đây là nội dung bài học Hóa học 10 Kết nối tri thức Bài 20: Ôn tập chương 6 do THPT Ngô Thì Nhậm biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Ôn tập chương 6. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường THPT Ngô Thì Nhậm
Chuyên mục: Hoá học 10