Hóa học 10 Bài 30: Lưu huỳnh được THPT Ngô Thì Nhậm biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 10 Bài 30
Vị trí, cấu hình electron nguyên tử
– Nguyên tử lưu huỳnh có số hiệu nguyên tử là 16, thuộc nhóm VIA, chu kì 3 của bảng tuần hoàn các nguyên tố hóa học.
– Nguyên tử lưu huỳnh có cấu hình electron: 1s22s22p63s23p4. Lớp ngoài cùng có 6 electron.
Tính chất vật lí
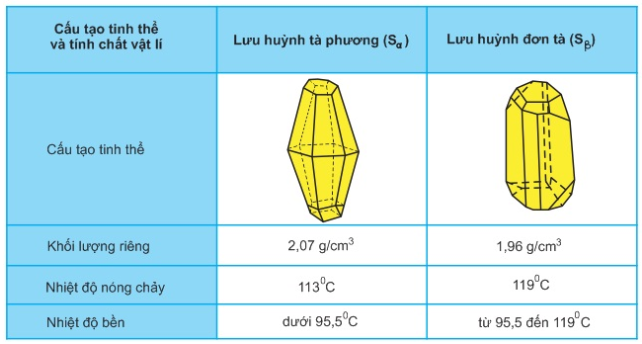
– Lưu huỳnh có 2 dạng thù hình: lưu huỳnh tà phương (Sα) và lưu huỳnh đơn tà (Sβ).
– Chúng khác nhau về cấu tạo tinh thể và 1 số tính chất vật lí nhưng có tính chất hóa học giống nhau. Hai dạng thù hình có thể biến đổi qua lại với nhau tùy theo điều kiện nhiệt độ.
Tính chất hóa học của lưu huỳnh
Lưu huỳnh trong hợp chất có các số oxi hóa -2; +4; +6. Như vậy khi tham gia phản ứng hóa học số oxi hóa của lưu huỳnh có thể tăng hoặc có thể giảm. Ta nói, lưu huỳnh có tính oxi hóa và tính khử.
Tác dụng với kim loại và hiđro
S thể hiện tính oxi hóa khi tác dụng với kim loại và hidro.
– Tác dụng với hiđro tạo thành khí hiđrosunfua:
H2 + S → H2S
– Tác dụng với kim loại tạo thành muối sunfua:
Fe + S → FeS
Zn + S → ZnS
Bột sắt tác dụng với bột lưu huỳnh
Chú ý: Lưu huỳnh có thể phản ứng với thủy ngân ngay điều kiện thường:
Hg + S → HgS
Tác dụng với phi kim và hợp chất
S thể hiện tính khử khi tác dụng với 1 số phi kim và 1 số hợp chất có tính oxi hóa
– Tác dụng với phi kim:
S + O2 → SO2
S + 3F2 → SF6
Lưu huỳnh cháy trong oxi
– Tác dụng với các chất có tính oxi hóa mạnh
S + 2H2SO4 đặc →3SO2 + 2H2O
S + 4HNO3 đặc →2H2O + 4NO2 + SO2
Ứng dụng
Lưu huỳnh là nguyên liệu quan trọng cho nhiều ngành công nghiệp:
– 90% lượng lưu huỳnh khai thác dùng để sản xuất H2SO4.
– 10% lượng lưu huỳnh còn lại dùng để lưu hóa cao su, chế tạo diêm, sản xuất chất tẩy trắng bột giấy, chất dẻo ebonit, dược phẩm, phẩm nhuộm, chất trừ sâu, diệt nấm …
Trạng thái tự nhiên, sản xuất lưu huỳnh
Trạng thái tự nhiên
– Trong tự nhiên lưu huỳnh có nhiều ở dạng đơn chất, tạo thành những mỏ lớn trong vỏ Trái Đất.
Mỏ lưu huỳnh lộ thiên
– Ngoài ra lưu huỳnh còn có ở dạng hợp chất như các muối sunfat, sunfua …
Khai thác lưu huỳnh
Bạn đang xem: Hóa học 10 Bài 30: Lưu huỳnh – Giải bài tập SGK Hóa học 10 Bài 30
– Để khai thác lưu huỳnh trong mỏ lưu huỳnh dưới lòng đất, người ta dùng thiết bị đặc biệt để nén nước siêu nóng (170oC) vào mỏ lưu huỳnh làm lưu huỳnh nóng chảy và đẩy lên mặt đất.
– Sau đó lưu huỳnh được tách ra khỏi các tạp chất.
Giải bài tập SGK Hóa học 10 Bài 30
Bài 1 (trang 132 SGK Hóa 10)
Lưu huỳnh tác dụng với aixt sunfuric đặc, nóng:
S + 2H2SO4 → 3SO2 + 2H2O
Trong phản ứng này, tỉ lệ số nguyên tử lưu huỳnh bị khử : số nguyên tử lưu huỳnh bị oxi hóa là:
A. 1 : 2.
B. 1 : 3.
C. 3 : 1.
D. 2 : 1.
Chọn đáp án đúng.
Lời giải:
D đúng.
S là chất khử (chất bị oxi hóa) ⇒ Số nguyên tử S bị oxi hóa là 1
H2SO4 là chất oxi hóa (chất bị khử) ⇒ Số nguyên tử S bị khử là 2
⇒ tỉ lệ số nguyên tử S bị khử: số nguyên tử S bị oxi hóa là: 2:1
Bài 2 (trang 132 SGK Hóa 10)
Dãy đơn chất nào sau đây vừa có tính oxi hóa vừa có tính khử?
A. Cl2 , O3, S.
B. S, Cl2, Br2.
C. Na, F2, S.
D. Br2, O2, Ca.
Lời giải:
B đúng.
Bài 3 (trang 132 SGK Hóa 10)
Có thể dự đoán sự thay đổi như thế nào về khối lượng riêng, về nhiệt độ nóng chảy khi giữ lưu huỳnh đơn tà (SB ) dài ngày ở nhiệt độ phòng?
Lời giải:
Ở nhiệt độ phòng, có sự chuyển hóa từ Sβ → Sα vậy khi giữ Sβ vài ngày ở nhiệt độ phòng thì:
– Khối lượng riêng của lưu huỳnh tăng dần.
– Nhiệt độ nóng chảy của lưu huỳnh giảm dần.
Bài 4 (trang 132 SGK Hóa 10)
Đun nóng một hỗn hợp gồm có 0,650g bột kẽm và 0,224g bột lưu huỳnh trong ống nghiệm đậy kín không có không khí. Sau phản ứng, người ta thu được chất nào trong ống nghiệm? Khối lượng là bao nhiêu?
Lời giải:
⇒ S phản ứng hết, Zn phản ứng dư
Phương trình hóa học của phản ứng
Zn + S ZnS
nZn phản ứng = 0,007 mol ⇒ nZnS = 0,007 mol.
Khối lượng các chất sau phản ứng:
mZn dư = (0,01 – 0,007) × 65 = 0,195g.
mZnS = 0,007 × 97 = 0,679g.
Bài 5 (trang 132 SGK Hóa 10)
1,10g hỗn hợp bột sắt và bột nhôm tác dụng vừa đủ với 1,28g bột lưu huỳnh.
a) Viết các phương trình hóa học của phản ứng xảy ra.
b) Tính tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp ban đầu, theo:
– lượng chất.
– khối lượng chất.
Lời giải:
a) Phương trình hóa học của phản ứng
Fe + S → FeS
2Al + 3S → Al2S3
b) Gọi nFe = x mol, theo PT ⇒ nS (1) = nFe = x mol
Gọi nAl = y mol, theo PT ⇒ nS (2) = . nAl = . y mol
⇒ nS = x + . y = 0,04 mol.
mhh = 56x + 27y = 1,1.
Giải hệ phương trình ta có x = 0,01 mol, y= 0,02 mol.
Tỉ lệ % sắt và nhôm trong hỗn hợp theo lượng chất ( theo số mol là):
Tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp theo khối lượng chất:
mAl = 0,02 x 27 = 0,54g
mFe = 0,01 x 56 = 0,56g.
%mAl = × 100% = 49,09%
%mFe = 100% – 49,09% = 50,91%
Trắc nghiệm Hóa học 10 Bài 30 có đáp án
Bài 1: Cho 11 gam hỗn hợp bột sắt và bột nhôm tác dụng với bột lưu huỳnh trong điều kiện không có không khí) thấy có 12,8 gam lưu huỳnh tham gia phản ứng. Khối lượng sắt có trong 11 gam hỗn hợp đầu là
A. 5,6 gam.
B. 11,2 gam.
C. 2,8 gam.
D. 8,4 gam.
Lời giải
Đáp án: A
nS = 12,8/32 = 0,4 (mol)
⇒ mhh = mFe + mAl
Bảo toàn electron: 2nFe+ 3nAl = 2nS
⇒ 56nFe + 27 nAl = 11 ; 2nFe + 3nAl = 2.0,4)
⇒ nFe = 0,1 nAl = 0,2) ⇒ mFe = 0,1.56 = 5,6 (gam)
Bài 2: Trong 5,6 gam bột sắt với 2,4 gam bột lưu huỳnh rồi nung nóng (trong điều kiện không có không khí), thu được hỗn hợp rắn M. Cho M tác dụng với lượng dư dung dịch HCl, giải phóng hỗn hợp khí X và còn lại một phần không tan G. Để đốt cháy hoàn toàn X và G cần vừa đủ V lít khí O2 (đktc). Giá trị của V là
A. 2,80
B. 3,36
C. 3,08
D. 4,48
Lời giải
Đáp án: A
nFe = 5,6/56 = 0,1 (mol); nS = 2,4/32 = 0,075 (mol)
Bảo toàn electron ⇒ 4nO2 = 2nFe + 4nS = 2.0,1 + 4.0,075
⇒ nO2 = 0,125 mol
⇒ V = 0,125. 22,4 = 2,8 (lít)
Bài 3: Nung nóng hỗn hợp bột X gồm a mol Fe và b mol S trong khí trơ, hiệu suất phản ứng bằng 50%, thu được hỗn hợp rắn Y. Cho Y vào dung dịch HCl dư, sau khi các phản ứng xảy ra haonf toàn, thu được hỗn hợp khí Z có tỉ khối so với H2 bằng 5. Tỉ lệ a:b bằng
A. 2:1
B. 1:1
C. 3:1
D. 3:2
Lời giải
Đáp án: A
Fe + S to → FeS
FeS + 2HCl → FeCl2 + H2S; Fe + 2HCl → FeCl2 + H2
MZ = 5.2 = 10; Chọn 1 mol Z
⇒ nH2 + nH2S = 1
2nH2 + 34nH2S=10
⇒ nH2 = 0,75 ; nH2S = 0,25
nFeS = nH2S = 0,25 mol; nFe (dư) = nH2 = 0,75 mol
⇒ nFe(bđ) = 0,25 + 0,75 = 1 (mol) ⇒ nS(bđ) = 0,25.100/50 = 0,5 (mol)
⇒ a : b = 1 : 0,5 = 2 : 1
Bài 4: Lưu huỳnh tác dụng với axit sunfuric đặc, nóng:
S + 2H2SO4 đặc 3SO2 + 2H2O
Trong phản ứng này, tỉ lệ số nguyên tử lưu huỳnh bị khử và số nguyên tử lưu huỳnh bị oxi hoá là:
A. 1 : 2.
B. 1 : 3.
C. 3 : 1.
D. 2 : 1.
Lời giải
Đáp án: D
Bài 5: Lưu huỳnh có thể tồn tại ở những trạng thái số oxi hoá nào?
A. -2; +4; +5; +6
B. -3; +2; +4; +6.
C. -2; 0; +4; +6
D. +1 ; 0; +4; +6
Lời giải
Đáp án: C
Bài 6: Cấu hình electron ở trạng thái kích thích của S khi tạo SO2 là:
A. 1s22s22p63s23p4
B. 1s22s22p63s23p33d1
C. 1s22s22p63s23p23d2
D. 1s22s22p63s13p33d2
Lời giải
Đáp án: B
Khi tạo SO2, S ở trạng thái kích thích, 1 e của phân lớp 3p được chuyển lên phân lớp 3d tạo ra 4e độc thân
Vậy cấu hình e ở trạng thái kích thích của S là: 1s22s22p63s23p33d1
Bài 7: Tính chất vật lí nào sau đây không phải của lưu huỳnh
A. chất rắn màu vàng
B. không tan trong nước
C. có tncthấp hơn tscủa nước
D. tan nhiều trong benzen
Lời giải
Đáp án: C
Lưu huỳnh tà phương nóng chảy ở 113oC, lưu huỳnh đơn tà nóng chảy ở 119oC
→ Nhiệt độ nóng chảy của S cao hơn nhiệt độ sôi của nước.
Bài 8: So sánh tính chất cơ bản của oxi và lưu huỳnh ta có
A. tính oxi hóa của oxi < lưu huỳnh
B. tính khử của lưu huỳnh > oxi
C. tính oxi hóa của oxi = tính oxi hóa của S
D. tính khử của oxi = tính khử của S
Lời giải
Đáp án: B
→ Tính oxi hóa của oxi mạnh hơn lưu huỳnh; tính khử của lưu huỳnh mạnh hơn oxi.
Bài 9: S vừa là chất khử, vừa là chất oxi hóa trong phản ứng nào sau đây?
A. S + O2→ SO2
B. S + 6HNO3→ H2SO4+ 6NO2 + 2H2O
C. S + Mg → MgS
D. S + 6NaOH → 2Na2S + Na2SO3+ 3H2O
Lời giải
Đáp án: D
Bài 10: Ứng dụng nào sau đây không phải của S?
A. Làm nguyên liệu sản xuất axit sunfuric.
B. Làm chất lưu hóa cao su.
C. Khử chua đất.
D. Điều chế thuốc súng đen.
Lời giải
Đáp án: C
Bài 11: Nguyên tố lưu huỳnh có số hiệu nguyên tử là 16. Vị trí của lưu huỳnh trong bảng tuần hoàn các nguyên tố hóa học là
A. chu kì 3, nhóm VIA.
B. chu kì 5, nhóm VIA.
C. chu kì 3, nhóm IVA.
D. chu kì 5, nhóm IVA.
Lời giải
Đáp án: A
Bài 12: Cho các phản ứng hóa học sau:
S + O2 to → SO2
S + 3F2 to → SF6
S + Hg → HgS
S + 6HNO3 (đặc) to → H2SO4 + 6NO2 + 2H2O
Trong các phản ứng trên, số phản ứng trong đó S thể hiện tính khử là
A. 3
B. 2
C. 4
D. 1
Lời giải
Đáp án: A
Bài 13: Hơi thủy ngân rất dộc, bởi vậy khi làm vỡ nhiệt kế thủy ngân thì chất bột được dùng để rắc lên thủy ngân rồi gom lại là
A. vôi sống.
B. cát.
C. muối ăn.
D. lưu huỳnh.
Lời giải
Đáp án: D
Bài 14: Nguyên tử S đóng vai trò vừa là chất khử, vừa là chất oxi hóa trong phản ứng nào sau đây?
A. 4S + 6NaOH (đặc) to→ 2Na2S + Na2S2O3+3H2O
B. S + 3F2 to→ SF6
C. S + 6HNO3(đặc) to→ H2SO4 + 6NO2 + 2H2O
D. S + 2Na to→ Na2S
Lời giải
Đáp án: A
Bài 15: Đun nóng 4,8 gam bột Mg với 9,6 gam bột lưu huỳnh (trong điều kiện không có không khí), thu được chất rắn X. Cho toàn bộ X vào lượng dư dung dịch HCl, thu được V lít khí (đktc). Giá trị của V là
A. 2,24
B. 3,36
C. 4,48
D. 6,72
Lời giải
Đáp án: C
Mg + S to → MgS
nMg = 4,8/24 = 0,2 (mol); nS = 9,6/32 = 0,3 (mol) ⇒ S dư; nMgS = 0,2 (mol)
MgS + 2HCl → MgCl2 + H2S ↑
⇒ V = 0,2.22,4 = 4,48 (lít)
******************
Trên đây là nội dung bài học Hóa học 10 Bài 30: Lưu huỳnh do THPT Ngô Thì Nhậm biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Lưu huỳnh. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường THPT Ngô Thì Nhậm
Chuyên mục: Hoá học 10