Hóa học 11 Bài 37: Nguồn hiđrocacbon thiên nhiên được THPT Ngô Thì Nhậm biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 11 Bài 37
A. Dầu mỏ
I. Trạng thái thiên nhiên, tính chất vật lý và thành phần hóa học
1. Trạng thái thiên nhiên, tính chất vật lý
– Dầu mỏ là một hỗn hợp lỏng, sánh, màu nâu đen, có mùi đặc trưng, nhẹ hơn nước và không tan trong nước. Dầu mỏ được khai thác từ các mỏ dầu dưới lòng đất (trong lục địa cũng như ngoài thềm lục địa).
2. Thành phần hóa học
– Dầu mỏ là một thành phần hóa học phức tạp gồm hàng trăm hiđrocacbon thuộc các loại ankan, xicloankan, aren (hiđrocacbon thơm).
– Ngoài hiđrocacbon ra, trong dầu mỏ còn có một lượng nhỏ các chất hữu cơ chứa oxi, nitơ, lưu huỳnh và vết các chất vô cơ.
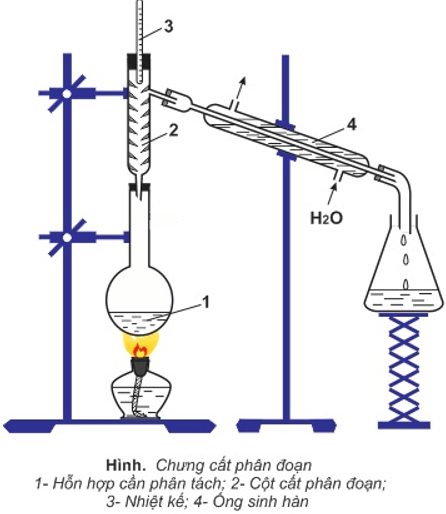
II. Chưng cất dầu mỏ
1. Chưng cất dưới áp suất thường
a. Chưng cất phân đoạn trong phòng thí nghiệm
– Để phân tách các chất có nhiệt độ sôi khác nhau không nhiều, người ta dùng phương pháp chưng cất phân đoạn.
– Ở cột phân đoạn, hỗn hợp hơi càng lên cao càng giàu hợp phần có nhiệt độ sôi thấp, vì hợp phần có nhiệt độ sôi cao đã bị ngưng đọng dần từ dưới lên.
b. Chưng cất phân đoạn dầu mỏ
– Dầu khai thác từ mỏ lên gọi là dầu thô.
– Dầu thô sau khi sơ chế loại bỏ nước, muối, được chưng cất ở áp suất thường trong các tháp chưng cất phân đoạn liên tục cao vài chục mét.
– Nhờ vậy, người ta tách được những phân đoạn dầu có nhiệt độ sôi khác nhau.
2. Chưng cất dưới áp suất cao
– Phân đoạn sôi ở nhiệt độ < 180oC được chưng cất tiếp ở áp suất cao.
– Nhờ chưng cất ở áp suất cao người ta tách được phân đoạn:
+ Phân đoạn C1−C2, C3−C4 dùng làm nhiên liệu khí hoặc khí hóa lỏng hoặc dẫn sang nhà máy sản xuất hóa chất.
+ Phân đoạn lỏng (C5−C6) gọi là ete dầu hỏa được dùng làm dung môi hoặc nguyên liệu cho nhà máy sản xuất hóa chất.
+ Phân đoạn (C6−C10) là xăng, nhưng thường có chất lượng thấp nên phải qua chế hóa bằng phương pháp rifominh.
3. Chưng cất dưới áp suất thấp
– Phần còn lại sau khi chưng cất ở nhiệt độ thường (có thể chiếm tới 40% dầu thô) là một hỗn hợp nhớt đặc, màu đen, gọi là cặn mazut.
– Khi chưng cất cặn mazut dưới áp suất thấp, ngoài phân đoạn linh động hơn dùng crackinh người ta thu được dầu nhờn (để bôi trơn máy), vazơlin và parafin (dùng trong y dược, dùng làm nến, …). Cặn đen còn lại được gọi là atphan dùng để rải đường.
– Tất cả quá trình chưng cất dầu mỏ để tách lấy các sản phẩm trên được gọi là tinh cất, hoặc thông thường còn gọi là “lọc dầu “.
III. Chế biến dầu mỏ bằng phương pháp hóa học
Bạn đang xem: Hóa học 11 Bài 37: Nguồn hiđrocacbon thiên nhiên – Giải bài tập SGK Hóa học 11 Bài 37
– Hai phương pháp chủ yếu chế hóa dầu mỏ là rifominh và crackinh:
1. Rifominh
– Xăng thu được từ chưng cất dầu mỏ chứa chủ yếu là những ankan không nhánh vì vậy có chỉ số octan thấp. Để tăng chỉ số octan, người ta dùng phương pháp rifominh.
– Rifominh là quá trình dùng xúc tác và nhiệt biến đổi cấu trúc của hiđrocacbon từ không phân nhánh thành phân nhánh, từ không thơm thành thơm.
– Trong quá trình rifominh xảy ra 3 loại phản ứng chủ yếu sau:
+ Chuyển ankan mạch thẳng thành ankan mạch nhánh và xicloankan:
+ Tách hiđro chuyển xicloankan thành aren:
+ Tách hiđro chuyển ankan thành aren:
2. Crăkinh
– Crăkinh là quá trình bẻ gãy phân tử hiđrocacbon mạch dài thành các phân tử hiđrocacbon mạch ngắn hơn nhờ tác dụng của nhiệt (crăkinh nhiệt) hoặc của xúc tác và nhiệt (crăkinh xúc tác).
a. Crăkinh nhiệt
– Crăkinh nhiệt thực hiện ở nhiệt độ trên 700−900oC chủ yếu tạo ra eten, propen, buten và penten dùng làm monome để sản xuất polime.
b. Crăkinh xúc tác
– Crăkinh xúc tác chủ yếu nhằm chuyển hiđrocacbon cacbon mạch dài của các phân đoạn có nhiệt độ sôi cao thành xăng nhiên liệu.
– Kết luận: Chế biến dầu mỏ bao gồm chưng cất dầu mỏ và chế biến bằng phương pháp hóa học.
– Sơ đồ chế biến dầu mỏ thành các sản phẩm được mô tả như hình dưới.
B. Khí dầu mỏ và khí thiên nhiên
I. Thành phần khí dầu mỏ và khí thiên nhiên
– Khí mỏ dầu còn gọi là khí đồng hành. Khí mỏ dầu có trong các mỏ dầu. Khí thiên nhiên là khí chứa trong các mỏ khí riêng biệt.
– Thành phần của khí mỏ dầu và khí thiên nhiên ở các mỏ khác nhau dao động như các số liệu ở bảng dưới đây:
II. Chế biến, ứng dụng của dầu mỏ và khí thiên nhiên
C. Than mỏ
I. Chưng khô than béo
II. Chưng cất nhựa than đá
– Nhựa than đá đem chưng cất sẽ thu được các hiđrocacbon thơm, dị vòng thơm và các dẫn xuất của chúng.
– Ví dụ: ở các khoảng nhiệt độ tăng dần sẽ thu được các phân đoạn sau:
– Phân đoạn sôi ở 80−170oC, gọi là dầu nhẹ, chứa benzen, toluen, xilen, …
– Phân đoạn sôi ở 170−230oC, gọi là dầu trung, chứa naphtalen, phenol, piriđin, …
– Phân đoạn sôi ở 230−270oC, gọi là dầu nặng, chứa crezol, xilenol, quiolin, …
– Cặn còn lại gọi là hắc ín dùng để rải đường.
Giải bài tập SGK Hóa học 11 Bài 37
Bài 1 (trang 169 SGK Hóa 11)
Hãy cho biết thành phần của dầu mỏ. Tại sao dầu mỏ lại không có nhiệt độ sôi nhất định? Có thể biểu thị thành phần của dầu mỏ bằng một công thức nhất định được không? Tại sao?
Lời giải:
– Dầu mỏ là hỗn hợp lỏng, sánh, màu sẫm, có mùi đặc trưng, nhẹ hơn nước và không tan trong nước. Dầu mỏ khai thác được từ các mỏ dầu dưới lòng đất (trong lục địa cũng như ngoài thềm lục đia). Dầu mỏ là một hỗn hợp phức tạp gồm hàng trăm hiđrocacbon thuộc các loại ankan, xicloankan, aren (hiđrocacbon thơm). Ngoài hiđrocacbon ra, trong dầu mỏ còn có một lượng nhỏ các chất hữu cơ chứa oxi, nitơ, lưu huỳnh và vết các chất vô cơ.
– Dầu ở các mỏ khác nhau thường có thành phần các lợi hiđrocacbon và các tạp chất rất khác nhau nhưng về thành phần nguyên tố thì thường như sau: 83-87% C, 11-14% H, 0,01-2% N. các kim loại nặng vào khoản phần triệu đến phần vạn.
Bài 2 (trang 169 SGK Hóa 11)
Khí thiên nhiên, khí mỏ dầu, khí mỏ dầu, khí lò cốc là gì? Nêu thành phần chính của mỗi loại khí này và ứng dụng của chúng?
Lời giải:
– Khí mỏ dầu còn gọi là khí đồng hành. Khi mỏ dầu có trong các mỏ dầu. Khí thiên nhiên là khí chứa trong các mỏ khí riêng biệt.
– Thành phần của khí mỏ dầu và khí thiên nhiên ở các mỏ khác nhau dao động như các số liệu ở bảng bên.
Các hợp phần Khoảng % thể tích Khí mỏ dầu Khí thiên nhiên Metan 50 ÷ 70 70 ÷ 95 Etan ~20 2 ÷ 8 Propan ~11 ~2 Butan ~4 ~1 Pentan (khí) ~2 ~1 N2, H2, H2S, He, CO2 ~12 4 ÷ 40
Bài 3 (trang 169 SGK Hóa 11)
Trình bày tóm tắt qui trình chưng cất dầu mỏ, các phân đoạn và ứng dụng của chúng? Có mấy loại than chính? Thành phần và cách chế biến chúng?
Lời giải:
Dầu khai thác từ mỏ lên gọi là dầu thô. Dầu thô sau khi sơ chế loại bỏ nước, muối, được chưng cất ở áp suất thường trong các tháp chưng cất phân đoạn liên tục cao vài chục mét. Nhờ vậy người ta tách được những phân đoạn dầu có nhiệt độ sôi khác nhau. Các phân đoạn đó được đưa đi sử dụng hoặc được chế biến tiếp.
Các sản phẩm chưng cất dầu mỏ ở áp suất thường
Nhiệt độ sôi Số nguyên tử C trong phân tử Hướng xử lí tiếp theo < 180ºC 1~10
Phân đoạn khí và xăng
Chưng cất áp suất cao, tách phân đoạn C1-C2, C3-C4 khỏi phân đoạn lỏng (C5-C10) 170-270ºC 10~16
Phân đoạn dầu hoả
Tách tạp chất chứ S, dùng làm nhiên liệu phản lực, nhiên liệu thắp sáng, đun nấu… 250-350ºC 16-21
Phân đoạn điêzen
Tách tạp chất chứa S, dùng làm nhiên liệu cho động cơ điêzen 350-400ºC 21-30
Phân đoạn dầu nhờn
Sản xuất dầu nhờn, làm nguyên liệu cho crăckinh > 400ºC > 30
Cặn mazut
Chưng cất áp suất thấp lấy nguyên liệu cho crăckinh, dầu nhờn, parafin, nhựa rải đường
Trong các loại than mỏ (than gầy, than béo, than bùn,…) hiện nay chỉ có than béo (than mỡ) được dùng để chế biến than cốc và cung cấp một lượng nhỏ hiđrocacbon. Than gầy chủ yếu dùng làm nhiên liệu cho các nhà máy nhiệt điện, xi măng, vv…
Bài 4 (trang 169 SGK Hóa 11)
Một loại khí thiên nhiên có thành phần trăm về thể tích các khí như sau: 85,0% metan; 10,0% etan; 2,0% nitơ và 3,0% cacbon đioxit.
a. Tính thể tích khí (đktc) cần để đun nóng 100,0 lít nước từ 20oC lên 100oC, biết nhiệt toả ra khi đốt 1 mol metan, 1 mol etan lần lượt bằng: 880kJ; 1560kJ và để nâng 1 ml nước lên 1o cần 4,18J.
b. Nếu chuyển được toàn bộ hiđrocacbon trong 1,000.103 m3 khí trên (đktc) thành axetilen, sau đó thành vinyl clorua với hiệu suất toàn bộ quá trình bằng 65,0% thì sẽ thu được bao nhiêu kilogam vinyl clorua?
Lời giải:
a. Nhiệt lượng cần để đun nóng 100 lít nước từ 20oC lên 100oC là:
4,18.(100 – 20).(100.103) = 33 440 000 (J) = 33 440 (kJ)
Gọi số mol khí thiên nhiên là x (mol)
⇒ nCH4 = 0,85x (mol) ; nC2H6 = 0,1x (mol)
Nhiệt lượng toả ra khi đốt cháy metan là: 880.0,85x = 748x (kJ)
Nhiệt lượng toả ra khi đốt cháy etan là: 15600.0,1x = 156x (kJ)
⇒ 748x + 156x = 33440
⇒ x = 36,991 (mol)
Vậy thể tích khí thiên nhiên cần dùng là:
36,991.22,4 = 828,6 (lít) (đktc)
b. Ta có:
828,6 (lít) khí thiên nhiên có 0,85x (mol) CH4 và 0,1x (mol) C2H6
106 (l) (lít) khí thiên nhiên có a (mol) CH4 và b (mol) C2H6
Số mol vinyl clorua thực tế là:
(18973,2 + 4464,3).0,65 = 15234,4(mol)
Khối lượng vinyl clorua thực tế thu được là:
15234,4. 62,5 = 952,15.103 (g) = 952,15 (kg)
******************
Trên đây là nội dung bài học Hóa học 11 Bài 37: Nguồn hiđrocacbon thiên nhiên do THPT Ngô Thì Nhậm biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Nguồn hiđrocacbon thiên nhiên. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường THPT Ngô Thì Nhậm
Chuyên mục: Hoá học 11