Hóa học 11 Bài 32: Ankin được THPT Ngô Thì Nhậm biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 11 Bài 32
I. Đồng đẳng, đồng phân, danh pháp
1. Đồng đẳng, cấu tạo
– Công thức chung: CnH2n-2 (n ≥ 2).
– Công thức đơn giản nhất là axetilen (CH≡CH).
– Trong phân tử có 1 liên kết ba: gồm 1 liên kết σ và 2 liên kết π. Nguyên tử cacbon ở liên kết ba tham gia 2 liên kết σ nhờ 2 obitan lai hóa sp, còn 2 liên kết π nhờ 2 obitan p không lai hóa.
– Đặc biệt phân tử CH≡CH có cấu trúc đường thẳng.
– Trong phân tử C2H2 có 2 liên kết π làm độ dài liên kết C≡C giảm so với liên kết C=C và C-C. Các nguyên tử cacbon không thể quay tự do quanh liên kết 3.
2. Danh pháp, đồng phân
a. Danh pháp
– Tên gọi gồm: tên mạch cacbon có đuôi in
C2H2: Etin
C3H4: Propin
C4H6: Buten
C5H8: Pentin
C6H10: Hexin
C7H16: Hepten
C8H14: Octin
C9H16: Nonin
C10H22: Đecen
– Mạch chính là mạch cacbon có nối ba với số thứ tự của cacbon ở nối ba nhỏ nhất.
– Ví dụ:
b. Đồng phân
– Hiện tượng đồng phân do: Mạch cacbon khác nhau, vị trí nối ba khác nhau. Ngoài ra còn có đồng phân dạng: ankadien và hiđrocacbon vòng.
– Từ C4 trở đi mới có đồng phân.
Ví dụ: C5H8 có 3 đồng phân.
CH≡C-CH2-CH2-CH3; CH3-C≡C-CH2-CH3
CH≡C-CH(CH3)-CH3
II. Tính chất vật lý
– Nhiệt độ nóng chảy nhiệt độ sôi tăng dần khi tăng số nguyên tử cacbon trong phân tử: 3 chất đầu là khí, các chất có n từ 5 → 16 là chất lỏng, khi n ≥ 17 là chất rắn.
– Đều ít tan trong nước, tan được trong một số dung môi hữu cơ (rượu, ete, …).
III. Tính chất hóa học
Cần lưu ý chất xúc tác trong mỗi phản ứng vì mỗi điều kiện có thể cho 1 chất sản phẩm khác nhau.
1. Phản ứng cộng
– Phản ứng cộng hiđrô
– Phản ứng cộng brom, clo
– Phản ứng cộng HX (X là OH; Cl; Br; CH3COO, …)
+ Phản ứng cộng của ankin với HX cũng tuân theo quy tắc Maccopnhicop.
– Phản ứng đimehoá, trimehoá
2. Phản ứng thế bằng ion kim loại
* Phản ứng của ank-1-in
CH≡CH + AgNO3 + NH3 → CAg≡CAg↓ (Bạc Axetilen) + 2NH4NO3
Nhận xét: Phản ứng này dùng để phân biệt ank-1-in với anken và ankan.
3. Phản ứng oxi hoá
– Phản ứng oxi hóa hoàn toàn
– Phản ứng oxi hoá không hoàn toàn: tương tự anken và ankađien, ankin cũng có khả năng làm mất màu dung dịch KMnO4.
IV. Điều chế và ứng dụng
1. Điều chế
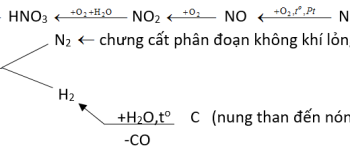
a. Điều chế axetilen
– Tổng hợp trực tiếp:
– Từ metan:
– Từ canxi cacbua:
– Tách H2 từ etan:
b. Điều chế các ankin khác
– Tách HX khỏi dẫn xuất đihalogen
CH2Br-CH2Br + 2KOH → CH≡CH + 2KBr + 2H2O
– Phản ứng giữa axetilua với dẫn xuất halogen:
CH3I + AgC ≡ CAg + CH3I → CH3 – C ≡ C – CH3 + 2AgI
2. Ứng dụng
– Axetilen dùng trong đèn xì axetilen – oxi để hàn và cắt kim loại do axetilen cháy tạo ra ngọn lửa ở khoảng 3000oC.
– Axetien và các akin khác còn được dùng làm nguyên liệu để tổng hợp các hóa chất khác như vinyl clorua, vinyl axetat, vinyl axetilen, …
Giải bài tập SGK Hóa học 11 Bài 32
Bài 1 (trang 145 SGK Hóa 11)
a. Viết công thức cấu tạo và gọi tên các ankin có công thức C4H6 và C5H8.
b. Viết công thức cấu tạo của các ankin có tên sau: pent-2-in ; 3-metylpent-1-in; 2,5- đimetylhex-3-in
Lời giải:
Bài 2 (trang 145 SGK Hóa 11)
Viết phương trình hóa học của phản ứng giữa propin và các chất sau:
a. hidro có xúc tác Pd/PbCO3
b. dung dịch brom (dư)
c. dung dịch bạc nitrat trong amoniac
d. hidro clorua có xúc tác HgCl2
Lời giải:
a. CH ≡ C – CH3 + H2 -Pb/PbCO3, to→ CH2 = CH – CH3
b. CH ≡ C – CH3 + 2Br2 → CHBr2 – CBr2 – CH3 dd(dư)
c. CH ≡ C – CH3 + AgNO3 + NH3 → AgC ≡ C – CH3 + NH4NO3
d. CH ≡ C – CH3 + HCl -HgCl2→ CH2 = CCl – CH3
Bài 3 (trang 145 SGK Hóa 11)
Trình bày phương pháp hóa học:
a. Phân biệt axetilen với etilen
b. Phân biệt ba bình không dán nhãn chứa mỗi khí không màu sau: metan, etilen, axetilen
Lời giải:
a. Cho tác dụng với dung dịch AgNO3 trong NH3 dư, chất nào tạo kết tủa thì đó là axetilen, chất nào không tạo kết tủa thì là etilen.
Phương trình phản ứng:
CH ≡CH + 2AgNO3 + 2NH3 → AgC≡CAg↓ +2NH4NO3
b. Lấy từ 3 bình các mẫu nhỏ để phân biệt.
– Lần lượt dẫn các mẫu khí qua dung dịch AgNO3/NH3, mẫu nào làm dung dịch xuất hiện kết tủa thì đó là axetilen
CH ≡CH + 2AgNO3 + 2NH3 → AgC≡CAg↓ +2NH4NO3
– Lần lượt dẫn 2 mẫu khí còn lại qua dung dịch brom, mẫu khí nào làm nhạt màu nước brom là etilen.
CH2=CH2 + Br2 → BrCH2=CH2Br
– Mẫu còn lại là metan.
Bài 4 (trang 145 SGK Hóa 11)
Cho các chất sau: metan,etilen, but-2-in và axetilen. Kết luận nào sau đây là đúng?
A. Cả 4 chất đều có khả năng làm mất màu dung dịch brom
B. Có 2 chất tạo kết tủa với dung dịch bạc nitrat trong amoniac
C. Có ba chất có khả năng làm mất màu dung dịch Brom
D. Không có chất nào làm nhạt màu dung dịch kali pemangalat
Lời giải:
– Đáp án C
– Phương trình hóa học:
CH2=CH2 +Br2→CH2Br-CH2Br
CH3-C≡C-CH3 + 2Br2→CH3-CBr2-CBr2 -CH3
CH≡CH + 2Br2→CHBr2 -CHBr2
Bài 5 (trang 145 SGK Hóa 11)
Dẫn 3,36 lít khí hỗn hợp A gồm propin và eilen đi vào một lượng dư dung dịch AgNO3 trong NH3 thấy còn 0,840 lít khí thoát ra và có m gam kết tủa. Các thể tích khí đo ở đktc
a. Tính phần trăm thể tích etilen trong A
b. Tính m
Lời giải:
a. Khi dẫn hỗn hợp A đi qua dung dịch AgNO3/NH3 (dư) thì propin sẽ tác dụng hết với AgNO3/NH3, etilen không tác dụng.
Vậy 0,840 lít khí thoát ra là etilen.
b. Thể tích proprin là: 3,36 – 0,84 = 2,52 (l)
nC3H4 = = 0,1125(mol)
⇒ m = 0,1125. 147 = 16,5375 (g)
Bài 6 (trang 145 SGK Hóa 11)
Trong số các ankin có công thức phân tử C5H8 có mấy chất tác dụng được với dung dịch AgNO3 trong NH3
A. 1 chất
B. 2 chất
C. 3 chất
D. 4 chất
Hãy chọn đáp án đúng
Lời giải:
CH ≡ C – CH2 – CH2 – CH3 + AgNO3 + NH3 → AgC ≡ C – CH2 – CH2 – CH3 + NH4NO3
Trắc nghiệm Hóa học 11 Bài 32 có đáp án
Bài 1: Dẫn 3,36 lít hỗn hợp X gồm metan và axetilen vào lượng dư dung dịch AgNO3 trong NH3, thu được m gam kết tủa và có 1,12 lít khí thoát ra. (Thể tích các khí đo (đktc)). Giá trị của m là
A.12,0
B. 24,0
C.13,2
D. 36,0
Lời giải
Đáp án: B
nC2H2 = (3,36 – 1,12) / 22,4 = 0,1 mol
⇒ nC2Ag2 = 0,1 mol ⇒ m = 0,1 . 240 = 24 gam
Bài 2: Cho 3,36 lít Hiđrocacbon X (đktc) phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, thu được 36 gam kết tủa. Công thức phân tử của X là
A.C4H4
B. C2H2
C. C4H6
D. C3H4
Lời giải
Đáp án: B
CxHy + nAgNO3 + nNH3 → CxHy-nAgn + nNH4NO3
n ↓ = nX = 3,36/22,4 = 0,15 (mol) ⇒ M ↓ = 36/0,15 = 240
MX = M ↓ – 107n ⇒ n = 2; MX = 26 (C2H2)
Bài 3: Hỗn hợp khí X gồm etilen và propin. Cho a mol X tác dụng với dung dịch AgNO3 trong NH3, thu được 17,64 gam kết tủa. Mặt khác a mol X phản ứng tối đa với 0,34 mol H2. Giá trị của a là
A.0,46
B. 0,22
C.0,34
D. 0,32
Lời giải
Đáp án: B
nC3H3Ag = 0,12mol ⇒ npropin = 0,12 mol
X phản ứng tối đa với 0,34 mol H2 ⇒ netilen + 2npropin = 0,34
⇒ netilen = 0,1 mol
⇒ a = 0,1 + 0,12 = 0,22 mol
Bài 4: Để tách riêng rẽ etilen và axetilen, các hoá chất cần sử dụng là:
A. nước vôi trong và dd HCl
B. AgNO3trong NH3và dd KOH
C. dd Br2và dd KOH
D. AgNO3trong NH3và dd HCl
Lời giải
Đáp án: D
Bài 5: Hiđro hoá hoàn toàn ankin X (xt Pd, PbCO3) thu được anken Y có CTPT là C5H10. Vậy Y không thể là anken nào sau đây?
A. 2-metylbut-1-en
B. 3-metylbut-1-en
C. pent-1-en
D. pent-2-en
Lời giải
Đáp án: A
Bài 6: Đốt cháy hoàn toàn hỗn hợp X gồm 2 ankin có tỷ lệ mol 1 : 1 thì thu được 15,68 lít CO2 (đktc) và 9,0 gam H2O. Vậy công thức phân tử của 2 ankin là:
A. C4H6và C5H8
B. C2H2 và C3H4
C. C3H4và C5H8
D. C3H4 và C4H6
Lời giải
Đáp án: D
nankin = nCO2 – nH2O = 0,7 – 0,5 = 0,2 mol
Gọi 2 ankin là: CnH2n-2 (0,1 mol) và CmH2m-2 (0,1 mol)
nCO2 = 0,1n + 0,1m = 0,7
⇒ n = 2; m = 5 hoặc n = 3, m = 4
Bài 7: Nhiệt phân metan ở 1500oC trong thời gian rất ngắn, toàn bộ khí sau phản ứng cho qua dung dịch AgNO3 dư trong amoniac thì thu được 24,0 gam kết tủa. Khí thoát ra được đốt cháy hoàn toàn thì thu được 9,0 gam H2O. Tính hiệu suất phản ứng nhiệt phân?
A. 33,33%
B. 60%
C. 66,67%
D. 40%
Lời giải
Đáp án: C
2CH4 -1500oC C2H2 + 3H2
nC2Ag2 = nC2H2 = 0,1mol
⇒ nCH4 pư = 0,2 mol; nH2 = 0,3 mol
nH2O = nH2 + 2nCH4 dư ⇒ nCH4 dư = 0,1 mol ⇒ nCH4 ban đầu = 0,3 mol
H% = 0,2 : 0,3. 100% = 66,67%
Bài 8: Cho các chất sau:
axetilen (1); propin (2);
but-1-in (3); but-2-in (4);
but-1-en-3-in (5); buta-1,3-điin (6).
Hãy cho biết có bao nhiêu chất khi cho tác dụng với AgNO3 trong dung dịch NH3 tạo kết tủa?
A. 3
B. 5
C. 6
D. 4
Lời giải
Đáp án: B
Các chất tác dụng với AgNO3 trong dung dịch NH3 tạo kết tủa 1, 2, 3, 5, 6.
Bài 9: Cho sơ đồ phản ứng sau:
CaCO3 -H = 100%→ CaO -H = 80%→ CaC2 -H = 100%→ C2H2.
Từ 100 gam CaCO3, hãy cho biết cuối quá trình phản ứng thu được bao nhiêu lít C2H2.
A. 35,84 lít
B. 17,92 lít
C. 22,4 lít
D. 20,16 lít
Lời giải
Đáp án: B
H% chung = 100%. 80%. 100% = 80%
CaCO3 -H = 80%→ C2H2
100g → 26g
100g -H = 80%→ 100. 26/100. 80% = 20,8g
⇒ V = 20,8 : 26 .22,4 = 17,92 lít
Bài 10: Hỗn hợp X gồm một ankan và một ankin. Cho hỗn hợp X qua dung dịch Br2 dư thấy thể tích hỗn hợp giảm đi một nửa. Tính thể tích O2 (đktc) cần dùng để đốt cháy hết 3,5 gam hỗn hợp X?
A. 8,96 lít
B. 5,6 lít
C. 2,8 lít
D. 8,4 lít
Lời giải
Đáp án: D
X qua Br2 dư thể tích giảm đi 1 nửa ⇒ nankan = nanken
⇒ nCO2 = nH2O = x mol
mC + mH = 12x + 2x = 3,5 ⇒ x = 0,25 mol
⇒ nO2 = nCO2 + 1/2. nH2O = 0,375 mol ⇒ VO2 = 8,4 lít
Bài 11: Chất X có công thức: CH3 – CH(CH3) – C CH. Tên thay thế của X là
A. 2-metylbut-2-en
B. 3-metylbut-1-in
C. 3-metylbut-1-en
D. 2-metylbut-3-in
Lời giải
Đáp án: B
Bài 12: Số liên kết σ trong mỗi phân tử etilen; axetilen;buta-1,2- đien lần lượt là
A. 3; 5; 9
B. 5; 3; 9
C. 4; 2; 6
D. 4; 3; 6
Lời giải
Đáp án: B
Bài 13: Chất nào sau đây tác dụng với dung dịch AgNO3 trong NH3 tạo kết tủa?
A. CH3- CH = CH2
B. CH2 – CH – CH = CH2.
C. CH3- C ≡ C – CH3
D. CH3 – CH2 – C ≡ CH2
Lời giải
Đáp án: D
Bài 14: Có bao nhiêu đồng phân ankin C5H8 tác dụng với dung dịch AgNO3 trong NH3?
A.3
B. 2
C. 4
D. 1
Lời giải
Đáp án: B
Bài 15: 4 gam một ankin X có thể làm mất tối đa 200m, dung dịch Br2 1M. Công thức phân tử của X là
A.C5H8
B. C2H2
C. C3H4
D. C4H6
Lời giải
Đáp án: C
nBr2 = 1.0,2 = 0,2 mol
2nX = nBr2 ⇒ nX = 0,1
⇒ MX = 40 (C3H4)
******************
Trên đây là nội dung bài học Hóa học 11 Bài 32: Ankin do THPT Ngô Thì Nhậm biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Ankin. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường THPT Ngô Thì Nhậm
Chuyên mục: Hoá học 11