Hóa học 9 Bài 56: Ôn tập cuối năm được THPT Ngô Thì Nhậm biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 9 Bài 56
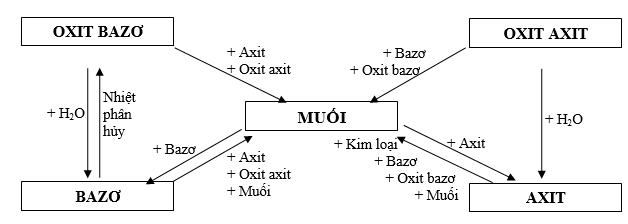
PHẦN I: HÓA VÔ CƠ
MỐI LIÊN HỆ GIỮA CÁC LOẠI HỢP CHẤT VÔ CƠ
PHẦN II. HÓA HỮU CƠ
Hợp chất Metan Etilen Axetilen Benzen CTPT PTK CH4 (M = 16) C2H4 (M = 28) C2H2 (M = 26) C6H6 (M = 78) Công thức cấu tạo Trạng thái Khí Lỏng Tính chất vật lý Không màu, không mùi, ít tan trong nước, nhẹ hơn không khí. Không màu, không tan trong nước, nhẹ hơn nước, hoà tan nhiều chất, độc. Tính chất hoá học giống nhau Có phản ứng cháy sinh ra CO2 và H2O Tính chất hóa học khác nhau Chỉ tham gia phản ứng thế – Có phản ứng cộng
– Có phản ứng trùng hợp
Có phản ứng cộng Vừa có phản ứng thế (dễ) và phản ứng cộng (khó) Ứng dụng Làm nhiên liệu, nguyên liệu trong đời sống và trong công nghiệp Làm nguyên liệu điều chế nhựa PE, rượu etylic, axit axetic, kích thích quả mau chín. Làm nhiên liệu hàn xì, thắp sáng, là nguyên liệu sản xuất PVC, cao su … Làm dung môi, diều chế thuốc nhuộm, dược phẩm, thuốc bảo vệ thực vật… Điều chế Có trong khí thiên nhiên, khí đồng hành, khí bùn ao. Sản phẩm chế hoá dầu mỏ, sinh ra khi quả chín Sản phẩm chế hoá dầu mỏ Sản phẩm chưng cất nhựa than đá. Nhận biết Không làm mất màu dd brom
Làm mất màu clo ngoài ánh sáng
Làm mất màu dung dịch brom Làm mất màu dung dịch brom Không làm mất màu dd brom
Không tan trong nước
RƯỢU ETYLIC AXIT AXETIC Công thức CTPT: C2H6O
CTCT:
Viết gọn: CH3 – CH2 – OH
CTPT: C2H4O2
CTCT:
Viết gọn: CH3 – COOH
Là chất lỏng, không màu, dễ tan và tan nhiều trong nước. Sôi ở 78,3°C, nhẹ hơn nước, hoà tan được nhiều chất như iot, benzen… Sôi ở 118°C, có vị chua (dd 2-5% làm giấm ăn) Tính chất hoá học. – Phản ứng với Na:
2C2H5OH + 2Na → 2C2H5ONa + H2
2CH3COOH + 2Na → 2CH3COONa + H2
– Rượu etylic tác dụng với axit axetic tạo thành este etyl axetat
– Cháy với ngọn lửa màu xanh, toả nhiều nhiệt
– Bị oxi hóa trong không khí khi có men xúc tác
– Mang đủ tính chất của axit: Làm đỏ quỳ tím, tác dụng với kim loại trước H, tác dụng với bazơ, oxit bazơ, muối của axit yếu hơn. Ứng dụng Dùng làm nhiên liệu, dung môi pha sơn, chế rượu bia, dược phẩm, điều chế axit axetic và cao su… Dùng để pha giấm ăn, sản xuất chất dẻo, thuốc nhuộm, dược phẩm, tơ… Điều chế Bằng phương pháp lên men tinh bột hoặc đường GLUCOZƠ SACCAROZƠ TINH BỘT VÀ XENLULOZƠ Công thức phân tử C6H12O6 C12H22O11 (C6H10O5)n
Tinh bột: n ≈ 1200 – 6000
Xenlulozơ: n ≈ 10000 – 14000
Trạng thái, Tính chất vật lý Chất kết tinh, không màu, vị ngọt, dễ tan trong nước Chất kết tinh, không màu, vị ngọt sắc, dễ tan trong nước, tan nhiều trong nước nóng Là chất rắn trắng. Tinh bột tan được trong nước nóng → hồ tinh bột. Xenlulozơ không tan trong nước kể cả đun nóng. Tính chất hoá học quan trọng Thuỷ phân khi đun nóng trong dd axit loãng Thuỷ phân khi đun nóng trong dd axit loãng
Hồ tinh bột làm dd Iot chuyển màu xanh
Ứng dụng Làm thức ăn, dược phẩm, dùng tráng gương, tráng ruột phích … Làm thức ăn, làm bánh kẹo, pha chế dược phẩm… Tinh bột là thức ăn cho người và động vật, là nguyên liệu để sản xuất đường glucozơ, rượu etylic. Xenlulozơ dùng để sản xuất giấy, vải, đồ gỗ và vật liệu xây dựng. Điều chế Có trong quả chín (nho), hạt nảy mầm; điều chế từ tinh bột. Có trong mía, củ cải đường, thốt nốt Tinh bột có nhiều trong củ, quả, hạt. Xenlulozơ có trong vỏ đay, gai, sợi bông, gỗ… Nhận biết Phản ứng tráng gương Có phản ứng tráng gương khi đun nóng trong dung dịch axit Nhận ra tinh bột bằng dd iot: có màu xanh đặc trưng
Giải bài tập SGK Hóa học 9 Bài 56
Bài 1 (trang 167 SGK Hóa 9)
Hãy nhận biết từng cặp chất sau đậy bằng phương pháp hóa học.
a) Dung dịch H2SO4 và dung dịch CuSO4.
b) Dung dịch HCl và dung dịch FeCl2.
c) Bột đá vôi CaCO3. Viết các phương trình phản ứng hóa học (nếu có).
Lời giải:
Có thể nhận biết như sau:
a) Cho đinh sắt vào hai ống nghiệm đựng hai dung dịch H2SO4 và dung dịch CuSO4 riêng biệt, nếu ống nghiệm nào sinh bọt khí đó là dung dịch H2SO4, còn ống nghiệm nào có chất rắn màu đỏ bám lên đinh sắt là dung dịch CuSO4.
Fe + H2SO4 → FeSO4 + H2
Fe + CuSO4 → FeSO4 + Cu
b) Cách 1: Cho viên kẽm vào hai ống nghiệm đựng hai chất trên, nếu ống nghiệm nào có bọt khí sinh ra là dung dịch HCl, còn ống nghiệm không có bọt khí sinh ra là dung dịch FeCl2.
Zn + 2HCl → ZnCl2 + H2
Zn + FeCl2 → ZnCl2 + Fe
Cách 2: Cho dung dịch NaOH vào hai ống nghiệm chứa hai chất trên, nếu ống nghiệm nào có kết tủa màu trắng xanh là FeCl2 còn ống nghiệm kia không có hiện tượng gì xảy ra là HCl.
FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
HCl + NaOH → NaCl + H2O.
c) Lấy một ít Na2CO3 và CaCO3 (có cùng khối lượng) cho vào hai ống nghiệm đựng dung dịch H2SO4 loãng dư. Ống nghiệm nào có khí bay ra, tan hết thì ống nghiệm đó chứa Na2CO3. Ống nghiệm nào có khí bay ra, không tan hết thì ống nghiệm đó chứa CaCO3, vì CaSO4 (ít tan) sinh ra phủ lên CaCO3 làm cho CaCO3 không tan hết.
Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O
CaCO3 + H2SO4 → CaSO4 + CO2 + H2O
Bài 2 (trang 167 SGK Hóa 9)
Có các chất sau: FeCl3, Fe2O3, Fe, Fe(OH)3, FeCl2. Hãy lập thành một dãy chuyển hóa và viết các phương trình hóa học. Ghi rõ điều kiện phản ứng.
Lời giải:
Có thể viết dãy phản ứng sau:
FeCl3 (1)→ Fe(OH)3 (2)→ Fe2O3 (3)→ Fe (4)→FeCl2.
Các PTHH:
(1) FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl.
(2) 2Fe(OH)3 Fe2O3 + 3H2O.
(3) Fe2O3 + 3CO 2Fe + 3CO2↑.
(4) Fe + 2HCl → FeCl2 + H2↑.
Bài 3 (trang 167 SGK Hóa 9)
Có muối ăn và các chất cần thiết. Hãy nêu hai phương pháp điều chế khí clo. Viết các phương trình hóa học.
Lời giải:
Bài 4 (trang 167 SGK Hóa 9)
Có các bình đựng khí riêng biệt: CO2, Cl2, CO, H2.
Hãy nhận biết mỗi khí trên bằng phương pháp hóa học. Viết các phương trình hóa học nếu có.
Lời giải:
Lấy mẫu thử từng chất, lần lượt cho:
– Dùng quỳ tím ẩm lần lượt nhúng vào các mẫu thử
+ Làm mất màu quỳ tím ẩm là khí Clo
+ Khí làm đỏ màu quỳ tím ẩm là CO2 (do CO2 + H2O → H2CO3).
+ 2 khí còn lại không có hiện tượng gì
– Hai khí còn lại đem đốt cháy, làm lạnh sản phẩm, nếu thấy có H2O ngưng tụ, thì đó là khí H2, còn lại là CO:
PTHH: 2H2 + O2 2H2O.
Bài 5 (trang 167 SGK Hóa 9)
Cho 4,8g hỗn hợp A gồm Fe, Fe2O3 tác dụng với dung dịch CuSO4 dư. Sau khi phản ứng kết thức, lọc lấy phần chất rắn không tan, rửa sạch bằng nước. sau đó cho phần chất rắn tác dụng với dung dịch HCl 1M thì còn lại 3,2g chất rắn màu đỏ.
a) Viết các phương trình hóa học
b) Tính thành phần phần trăm các chất trong hỗn hợp A ban đầu.
Lời giải:
Khi cho phần chất rắn tác dụng với dung dịch HCl thì còn lại 3,2g chất rắn màu đỏ, đó chính là đồng kim loại.
a) Phương trình hóa học.
Fe + CuSO4 → FeSO4 + Cu (1)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O (2)
nCu = nFe = 0,05 mol.
b) Thành phần phần trăm các chất
mFe = 0,05 x 56 = 2,8g.
Bài 1 (trang 168 SGK Hóa 9)
Những chất sau đây có điểm gì chung (thành phần, cấu tạo, tính chất)?
a) Metan, etilen, axetilen, bezen.
b) Rượu etylic, axit axetic, glucozơ, protein.
c) Protein, tinh bột, xenlulozơ, polietilen.
d) Etyl axetat, chất béo.
Lời giải:
Những chất có điểm chung sau:
a) Đều là Hiđrocacbon.
b) Đều là dẫn xuất của Hiđrocacbon.
c) Đều là hợp chất cao phân tử.
d) Đều là este.
Bài 2 (trang 168 SGK Hóa 9)
Dựa trên đặc điểm nào, người ta xếp các chất sau vào cùng một nhóm:
a) Dầu mỏ, khí tự nhiên, than đá, gỗ.
b) Glucozơ, saccarozơ, tinh bột, xenlulozơ.
Lời giải:
Người ta sắp xếp các chất vào cùng một nhóm vì:
a) Đều là nhiên liệu.
b) Đều là gluxit.
Bài 3 (trang 168 SGK Hóa 9)
Hoàn thành sơ đồ phản ứng:
Lời giải:
Bài 4 (trang 168 SGK Hóa 9)
Chọn câu đúng trong các câu sau:
a) Metan, etilen, axetilen đều làm mất màu dung dịch brom.
b) Etilen, axetilen, benzen đều làm mất màu dung dịch brom.
c) Metan, etilen, benzen đều không làm mất màu dung dịch brom.
d) Etilen, axetilen, benzen đều không làm mất màu dung dịch brom.
e) Axetilen, etilen đều làm mất màu dung dịch brom.
Lời giải:
Câu đúng là câu e.
Bài 5 (trang 168 SGK Hóa 9)
Nêu phương pháp hóa học để phân biệt các chất sau:
a) CH4, C2H4, CO2.
b) C2H5OH, CH3COOC2H5, CH3COOH.
c) Dung dịch glucozơ, dung dịch saccarozơ, dung dịch axit axetic.
Lời giải:
Phương pháp hóa học để phân biệt:
a) Cho các khí qua dung dịch Ca(OH)2 dư, khí nào cho kết tủa là khí CO2.
CO2 + Ca(OH)2 → CaCO3 + H2O
Lấy cùng một thể tích các khí còn lại cho tác dụng với cùng một thể tích dung dịch brom có cùng nồng độ, khí không làm mất màu dung dịch brom là CH4 , khí làm nhạt màu dung dịch brom là C2H4.
b) Cho dung dịch Na2CO3 vào ba ống nghiệm chứa các chất trên, chất trong ống nghiệm nào có khí bay ra là CH3COOH.
CH3COOH + Na2CO3 → 2CH3COONa + CO2 + H2O
(Có thể dùng quỳ tím, axit CH3COOH đổi màu quỳ tím thành đỏ).
Cho Na vào hai ống nghiệm còn lại, chất trong ống nghiệm nào cho khí bay ra là rượu etylic, chất không phản ứng là CH3COOC2H5.
c) Cho quỳ tím vào ba ống nghiệm chứa các chất tren, chất trong ống nghiệm nào đổi màu quỳ tím thành đỏ là axit axetic.
Cho AgNO3 trong dung dịch NH3 vào hai ống nghiệm còn lại và đun nóng, chất trong ống nghiệm nào có chất màu sáng bạc bám lên thành ống nghiệm là glucozơ, còn lại dung dịch không phản ứng là dung dịch saccarozơ.
Bài 6 (trang 168 SGK Hóa 9)
Đốt cháy 4,5g chất hữu cơ A thu được 6,6g khí CO2 và 2,7g H2O. Xác định công thức phân tử hợp chất hữu cơ A. Biết khối lượng mol của hợp chất là 60g.
Lời giải:
Đốt cháy hợp chất hữu cơ cho CO2 và H2O, hợp chất hữu cơ này chắc chắn có hai nguyên tố C và H, có thể có nguyên tố O.
nCO2 = 6,6 / 44 = 0,15 mol
⇒ Bt nguyên tố C ⇒ nC = nCO2 = 0,15 mol ⇒ mC = 0,15. 12 = 1,8g;
nH2O = 2,7 / 18 = 0,15 mol
⇒ BT nguyên tố H ⇒ nH = 2.nH2O = 0,15. 2 = 0,3 mol ⇒ mH = 0,3. 1 = 0,3g.
⇒ mO = 4,5 – 0,3 – 1,8 = 2,4g.
Hợp chất hữu cơ có nguyên tố O.
Đặt công thức phân tử hợp chất hữu cơ A là CxHyOz.
Tỉ lệ khối lượng C trong hợp chất là: 1,8/4,5 = (12.x)/60 ⇒ x = 2.
Tỉ lệ khối lượng H trong hợp chất là: 0,3/4,5 = y/60 ⇒ x = 4.
Tỉ lệ khối lượng O trong hợp chất là: 2,4/4,5 = (16.z)/60 ⇒ z = 2.
Công thức phân tử hợp chất hữu cơ A là C2H4O2.
Bài 7 (trang 168 SGK Hóa 9)
Đốt cháy hợp chất hữu cơ X bằng oxi thấy sản phẩm tạo ra gồm có CO2, H2O, N2. Hỏi X có thể là những chất nào trong các chất sau: tinh bột, benzen, chất béo, caosu, protein.
Lời giải:
Chất X là protein
Vì thành phần phân tử của tinh bột, benzen, chất béo và cao su chỉ gồm các nguyên tố C, H và O (có thể có O) nên khi đốt cháy sản phẩm cháy chỉ gồm CO2 và H2O.
Còn thành phần phân tử của protein ngoài C, H, O còn có N nên khi đốt cháy protein ngoài sản phẩm là CO2 , H2O còn thu được N2.
Trắc nghiệm Hóa học 9 Bài 56 (có đáp án)
Câu 1: Kim loại X phản ứng với axit HCl tạo muối XCl2. Kim loại X phản ứng với Cl2 tạo muối XCl3. X là
A. Cu.
B. Zn.
C. Al.
D. Fe.
Lời giải
Đáp án: D
Câu 2: Chất khí nào sau đây được dung làm nhiên liệu cho đèn xì để hàn cắt kim loại?
A. cacbon monooxit.
B. etilen.
C. metan.
D. axetilen.
Lời giải
Đáp án: D
Khi axetilen cháy trong oxi, nhiệt độ ngọn lửa có thể lên tới 3000°C. Vì vậy axetilen được sử dụng làm nhiên liệu trong đèn xì oxi – axetilen để hàn cắt kim loại.
Câu 3: Giấm ăn là dung dịch axit axetic có nồng độ
A. trên 25%.
B. 20%.
C. từ 2% – 5%.
D. từ 8% – 15%.
Lời giải
Đáp án: C
Câu 4: Benzen không tác dụng được với chất nào sau?
A. Khí H2 (xúc tác Ni, đun nóng).
B. Br2 (xúc tác bột Fe).
C. Khí O2 (nhiệt độ cao).
D. Br2 (trong dung môi nước).
Lời giải
Đáp án: D
Câu 5: Cho metan tác dụng với khí clo theo tỉ lệ mol 1 : 1, có ánh sáng thu được sản phẩm hữu cơ là
A. CH3Cl.
B. CH2Cl2.
C. CHCl3.
D. CCl4.
Lời giải
Đáp án: A
Câu 6: Cho 23 gam rượu etylic tác dụng với axit axetic (xúc tác H2SO4 đặc, đun nóng, hiệu suất phản ứng este hóa đạt 60%). Khối lượng etyl axetat (tính theo lượng rượu etylic) thu được là
A. 26,4 gam.
B. 30,8 gam.
C. 44,0 gam.
D. 32,1 gam.
Lời giải
Đáp án: A
Câu 7: Axit clohiđric phản ứng với tất cả các chất nào trong dãy sau?
A. Ca(OH)2, Cu.
B. Fe, Ag.
C. FeCl2, Mg.
D. Fe2O3, Al.
Lời giải
Đáp án: D
Loại A, B và C vì Cu, Ag và FeCl2 không phản ứng với HCl.
Câu 8: Thuốc thử để nhận biết dung dịch glucozơ và dung dịch rượu etylic là
A. phenolphtalein.
B. Na.
C. Quỳ tím.
D. AgNO3 trong NH3.
Lời giải
Đáp án: D
Sử dụng dung dịch AgNO3 trong NH3
+ Có chất màu sáng bạc bám trên thành ống nghiệm → glucozơ.
+ Không hiện tượng → rượu etylic.
Câu 9: Khí CO được dùng làm chất đốt trong công nghiệp, có lẫn tạp chất là CO2 và SO2. Hóa chất nào sau đây có thể loại bỏ các tạp chất trên?
A. H2O dư.
B. Dung dịch NaCl dư.
C. Dung dịch Ca(OH)2 dư.
D. Dung dịch HCl dư.
Lời giải
Đáp án: C
Sử dụng dung dịch Ca(OH)2 dư. SO2 và CO2 phản ứng bị giữ lại, còn CO không phản ứng thoát ra khỏi dung dịch thu được CO tinh khiết.
SO2 + Ca(OH)2 dư → CaSO3 (↓) + H2O
CO2 + Ca(OH)2 dư → CaCO3 (↓) + H2O
Câu 10: Đun nóng chất béo trong dung dịch NaOH thu được các sản phẩm là
A. Muối natri của axit axetic và glixerol.
B. Axit axetic và glixerol.
C. Axit béo và glixerol.
D. Muối natri của axit béo và glixerol.
Lời giải
Đáp án: D
Đun nóng chất béo trong dung dịch NaOH thu được muối natri của axit béo và glixerol.
Câu 11: Có thể phân biệt 3 dung dịch: HCl, Na2SO4, NaOH bằng một thuốc thử là
A. BaCl2
B. KMnO4
C. Quỳ tím
D. AgNO3
Lời giải
Đáp án: C
Sử dụng quỳ tím:
+ Quỳ tím chuyển sang màu đỏ → HCl.
+ Quỳ tím chuyển sang màu xanh → NaOH.
+ Quỳ tím không đổi màu → Na2SO4.
Câu 12: Cho 4,48g CaO tác dụng vừa đủ với axit H2SO4. Sau khi cô cạn sản phẩm, thu được bao nhiêu gam muối khan?
A. 10,88 gam.
B. 8,10 gam.
C. 4,48 gam.
D. 8,48 gam.
Lời giải
Đáp án: A
Câu 13: Dãy các chất đều làm mất mầu dung dịch brom là
A. C2H2, C6H6, CH4.
B. C2H2, CH4, C2H4.
C. C2H2, C2H4.
D. C2H2, H2, CH4.
Lời giải
Đáp án: C
C2H2 và C2H4 làm mất màu dung dịch brom.
Câu 14: Khi thuỷ phân 1 kg bột gạo có 80% tinh bột, thì khối lượng glucozơ thu được là bao nhiêu? Giả thiết rằng phản ứng xảy ra hoàn toàn.
A. 0,89 kg.
B. 0,98 kg.
C. 0,8 kg.
D. 1,8 kg.
Lời giải
Đáp án: A
Câu 15: Hoà tan 50 gam muối ăn vào 200 gam nước thu được dung dịch có nồng độ là
A. 15%.
B. 20%.
C. 18%.
D. 25%
Lời giải
Đáp án: B
Câu 16: Polime nào sau dây không phải là polime thiên nhiên?
A. Poli etilen.
B. Xenlulozơ.
C. Tơ tằm.
D. Tinh bột.
Lời giải
Đáp án: A
Câu 17: Khi cho giấm ăn vào sữa đậu nành có hiện tượng
A. sữa bò bị vón cục.
B. sữa bò và nước chanh hòa tan vào nhau.
C. xuất hiện màu xanh đặc trưng.
D. không có hiện tượng gì.
Lời giải
Đáp án: A
Câu 18: Để phân biệt tinh bột và xenlulozơ ta dùng
A. quỳ tím.
B. iot.
C. NaCl.
D. glucozơ.
Lời giải
Đáp án: B.
Câu 19: Đường nho là loại đường nào sau đây?
A. Mantozơ.
B. Glucozơ.
C. Fructozơ.
D. Saccarozơ.
Lời giải
Đáp án: B
Câu 20: Hòa tan hoàn toàn 6,5 gam Mg vào dung dịch CH3COOH. Thể tích khí H2 thoát ra (ở đktc) là
A. 0,56 lít.
B. 1,12 lít.
C. 2,24 lít.
D. 3,36 lít.
Lời giải
Đáp án: C
Ta có: nZn = 6,5 : 65 = 0,1 mol
→ Vkhí = 0,1.22,4 = 2,24 lít.
******************
Trên đây là nội dung bài học Hóa học 9 Bài 56: Ôn tập cuối năm do THPT Ngô Thì Nhậm biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Ôn tập cuối năm. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường THPT Ngô Thì Nhậm
Chuyên mục: Hoá học 9
Bạn đang xem: Hóa học 9 Bài 56: Ôn tập cuối năm – Giải bài tập SGK Hóa học 9 Bài 56