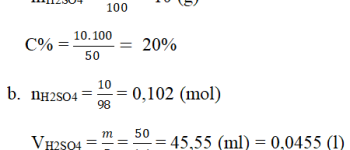Hóa học 8 Bài 22: Tính theo phương trình hóa học được THPT Ngô Thì Nhậm biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 8 Bài 22
Tìm khối lượng chất tham gia và chất sản phẩm
Cách làm:
– Bước 1: Viết phương trình
– Bước 2: tính số mol các chất
– Bước 3: dựa vào phương trình tính được số mol chất cần tìm
– Bước 4: tính khối lượng
Thí dụ 1:
cho 4g NaOH tác dụng với CuSO4 tạo ra Cu(OH)2 kết tủa và Na2SO4. Tính khối lượng Na2SO4
Các bước tiến hành
– Viết PTHH và cân bằng
2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4
Tính số mol NaOH tham gia phản ứng
nNaOH = = 0,1 mol
Tính số mol Na2SO4 thu được
Theo PTHH: 1 mol NaOH phản ứng thu được 0,5 mol Na2SO4
Vậy: 0,1 mol NaOH…………………0,05 mol Na2SO4
Tìm khối lương Na2SO4 thu được
mNa2SO4 = n×M = 0,05×142 = 7,1g
Thí dụ 2:
Tính khối lương NaOH cần dùng để điều chế 7,1g Na2SO4
Viết PTHH:
2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4
Tính số mol Na2SO4 sinh ra sau phản ứng
nNa2SO4 = = 0,05 mol
Tìm số mol NaOH tham gia phản ứng
Theo PTHH: để điều chế 1 mol Na2SO4 cần dùng 2 mol NaOH
Vậy muốn điều chế 0,05 mol Na2SO4 cần dùng 0,1 mol NaOH
Tính khối lương NaOH cần dùng
mNaOH = n×M = 0,1×40 = 4(g)
Tìm thể tích chất khí tham gia và sản phẩm
Cách làm:
– Bước 1: Viết PTHH
– Bước 2: Tìm số mol khí
– Bước 3: thông qua PTHH, tìm số mol chất cần tính
– Bước 4: Tìm thể tích khí
Thí dụ 1:
Lưu huỳnh cháy trong oxi hoặc trong không khí sinh ra lưu huỳnh đioxit SO2. Hãy tính thể tích (đktc) sinh ra, nếu có 4g khí O2 tham gia phản ứng
– Viết PTHH
S + O2 −to→ SO2
– Tìm số mol O2 sinh ra sau phản ứng:
nO2 = = 0,125 mol
– Tìm số mol SO2 sinh ra sau phản ứng
Theo PTHH: 1 mol O2 tham gia phản ứng sinh ra 1 mol SO2
Vậy : 0,125 mol O2 …………………………. 0,125 mol SO2
– Tìm thể tích khí SO2(đktc) sinh ra sau phản ứng
VSO2 = n.22,4 = 0,125.2,24 = 2,8 lít
Thí dụ 2:
Tìm thể tích khí oxi (đktc) cần dùng để đốt cháy hoàn toàn 64g lưu huỳnh
– Viết PTHH:
S + O2 −to→ SO2
– Tính số mol lưu huỳnh tham gia phản ứng
nS = = 2 mol
– Tính số mol O2 tham gia phản ứng
Theo PTHH: đốt cháy 1 mol S cần dùng 1 mol O2
Vậy : đốt cháy 2 mol S cần 2 mol O2
– Tính thể tích O2 cần dùng:
VO2 = 22,4 × n = 44,8 (l)
Giải bài tập SGK Hóa học 8 Bài 22
Bài 1 (trang 75 SGK Hóa 8)
Sắt tác dụng với axit clohiđric : Fe + 2HCl → FeCl2 + H2↑.
Nếu có 2,8g sắt tham gia phản ứng em hãy tìm:
a) Thể tích khí hiđro thu được ở đktc.
b) Khối lượng axit clohiđric cần dùng.
Lời giải:
a) PTPU
Theo pt: nH2 = nFe = 0,05 (mol)
VH2 = 22,4.n = 22,4.0,05 = 1,12 (l)
b) nHCl = 2.nFe = 2. 0,05 = 0,1 (mol)
mHCl = M.n = 0,1.36,5 = 3,65 (g)
Bài 2 (trang 75 SGK Hóa 8)
Lưu huỳnh (S) cháy trong không khí sinh ra chất khí mùi hắc, gây ho đó là lưu huỳnh đioxit (khí sunfurơ) có công thức hóa học là SO2.
a) Viết phương trình hóa học của lưu huỳnh cháy trong không khí.
b) Biết khối lượng lưu huỳnh tham gia phản ứng là 1,6g. Hãy tìm.
-Thể tích khí sunfurơ sinh ra ở đktc.
-Thể tích không khí cần dùng ở đktc. Biết oxi chiếm 1/5 thể tích không khí.
Lời giải:
a) Phương trình hóa học S + O2 SO2
b) nS = = 0,05 mol.
Theo phương trình trên, ta có:
nSO2 = nS = nO2 = 0,05 mol.
⇒ VSO2 = 0,05 .22,4 = 1,12 l.
⇒ VO2 = 22,4.0,05 = 1,12 l
Vì khí oxi chiếm thể tích của không khí nên thể tích không khí cần là
⇒ Vkk = 5VO2 = 5.1,12 = 5,6 l
Bài 3 (trang 75 SGK Hóa 8)
Có phương trình hóa học sau:
CaCO3 → CaO + CO2.
a) Cần dùng bao nhiêu mol CaCO3 để điều chế được 11,2g CaO?
b) Muốn điều chế được 7g CaO cần dùng bao nhiêu gam CaCO3?
c) Nếu có 3,5 mol CaCO3 tham gia phản ứng sẽ sinh ra bao nhiêu lít CO2 (đktc).
d) Nếu thu được 13,44 lít khí CO2 ở đktc thì có bao nhiêu gam chất rắn tham gia và tạo thành sau phản ứng.
Lời giải:
Phương trình hóa học CaCO3 → CaO + CO2.
a) nCaO = = 0,2 mol.
Theo PTHH thì nCaCO3 = nCaO = 0,2 (mol)
b) nCaO = = 0,125 (mol)
Theo PTHH thì nCaCO3 = nCaO = 0,125 (mol)
mCaCO3 = M.n = 100.0,125 = 12,5 (g)
c) Theo PTHH thì nCO2 = nCaCO3 = 3,5 (mol)
VCO2 = 22,4.n = 22,4.3,5 = 78,4 (lít)
d) nCO2 = = 0,6 (mol)
Theo PTHH nCaO = nCaCO3 = nCO2 = 0,6 (mol)
mCaCO3 = n.M = 0,6.100 = 60 (g)
mCaO = n.M = 0,6.56 = 33,6 (g)
Bài 4 (trang 75 SGK Hóa 8)
a) Cacbon oxit CO tác dụng với khí oxi tạo ra cacbon đioxit. Hãy viết phương trình hóa học.
b) Nếu muốn đốt cháy 20 mol CO thì phải dùng bao nhiêu mol O2 để sau phản ứng người ta chỉ thu được một chất khí duy nhất?
c) Hãy điền vào những ô trống số mol các chất phản ứng và sản phẩm có ở những thời điểm khác nhau. Biết hỗn hợp CO và O2 ban đầu được lấy đúng tỉ lệ về số mol các chất theo phương trình hóa học.
Lời giải:
a) Phương trình phản ứng:
2CO + O2 → 2CO2
b) Theo phương trình
c) Hoàn chỉnh bảng
Thời điểm t1 nCO còn 15mol ⇒ nCO đã phản ứng = 20 – 15= 5mol
Theo pt nCO2 = nCO(pư) = 5 mol
⇒ nO2 còn lại = 10 – 2,5 = 7,5 mol
Tương tự tính thời điểm t2 và thời điểm t3 ta được số liệu sau:
Số mol Các thời điểm Các chất phản ứng Sản phẩm CO O2 CO2 Thời điểm ban đầu t0 20 10 0 Thời điểm t1 15 7,5 5 Thời điểm t2 3 1,5 17 Thời điểm kết thúc t3 0 0 20
Bài 5 (trang 75 SGK Hóa 8)
Hãy tìm thể tích khí oxi đủ để đốt cháy hết 11,2 lít khí A.
Biết rằng:
– Khí A có tỉ lệ khối đối với không khí là 0,552.
– Thành phần theo khối lượng của khí A là: 75% C và 25% H.
Các thể tích khí đo ở đktc.
Lời giải:
dA/kk = 0,552 ⇒ Khối lượng mol của khí A: 29.0,552 = 16 (g)
Đặt CTHH của khí A là CxHy
Công thức hóa học của khí A là: CH4
PTPỨ:
Tỉ lệ số mol cũng chính là tỉ lệ thể tích.
Theo phương trình nO2 = 2.nCH4 ⇒ VO2 = 2.VCH4 = 2.11,2 = 22,4(l)
Trắc nghiệm Hóa học 8 Bài 22 (có đáp án)
Câu 1: Cho thanh magie cháy trong không khí thu được hợp chất magie oxit. Biết mMg = 7,2 g. Tính khối lượng hợp chất
A. 2,4 g
B. 9,6 g
C. 4,8 g
D. 12 g
Lời giải
Đáp án: C
nMg = 7,2/24 = 0,3 mol
2Mg + O2 → 2MgO
0,3 → 0,3 mol
mMgO = 0,3.40 = 4,8 g
Câu 2: Cho phương trình CaCO3 → CO2 + H2O
Để điều chế 2,24 l CO2 thì số mol CaCO3 cần dùng là
A. 1 mol
B. 0,1 mol
C. 0,001 mol
D. 2 mol
Lời giải
Đáp án: B
nCO2 = 2,24/22,4 = 0,1 mol
CaCO3 → CO2 + H2O
0,1 ← 0,1 (mol)
Câu 3: Ba + 2HCl → BaCl2 + H2
Để thu dược 4,16 g BaCl2 cần bao nhiêu mol HCl
A. 0,04 mol
B. 0,01 mol
C. 0,02 mol
D. 0,5 mol
Lời giải
Đáp án: A
nBaCl2 = 4,16/208 = 0,02 mol
Ba + 2HCl → BaCl2 + H2
0,04 ← 0,02 mol
Câu 4: Cho 5,6 g sắt tác dụng với dung dịch axit clohidric loãng thu được bao nhiêu ml khí H2
A. 2,24 ml
B. 22,4 ml
C. 2, 24.10-3 ml
D. 0,0224 ml
Lời giải
Đáp án: C
Fe + 2HCl → FeCl2 + H2
Nhìn vào phương trình thấy nFe = nH2 = 5,6/56 = 0,1 mol
VH2 = 0,1.22,4 = 2,24 l = 2,24.10-3 l
Câu 5: Cho 13,7 g Ba tác dụng với 3,2 g oxi thu được hợp chất oxit. Tính khối lượng oxi sau phản ứng
A. 3,2 g
B. 1,6 g
C. 6,4 g
D. 0,8 g
Lời giải
Đáp án: B
Khối lượng oxi sau phản ứng là m = 0,05.32 = 1,6 g
Câu 6: Cho 98 g H2SO4 loãng 20% phản ứng với thanh nhôm thấy có khí bay lên. Xác định thể tích khí đó
A. 4,8 l
B. 2,24 l
C. 4,48 l
D. 0,345 l
Lời giải
Đáp án: C
Câu 7: Cho 8,45 g Zn tác dụng với 5,376 l khí Clo (đktc). Hỏi chất nào sau phản ứng còn dư
A. Zn
B. Clo
C. Cả 2 chất
D. Không có chất dư
Lời giải
Đáp án: B
Câu 8: Nhiệt phân 2,45 g KClO3 thu được O2. Cho Zn tác dụng với O2 vừa thu được . Tính khối lượng chất thu được sau phản ứng
A. 2,45 g
B. 5,4 g
C. 4,86 g
D. 6,35 g
Lời giải
Đáp án: D
Sau phản ứng thu được KCl và ZnO
m = 0,06.81+ 0,02.74,5 = 6,35 g
Câu 9: Đốt cháy 11,2 l CH4 trong không khí thu được khí và nước. Xác định khí và cho biết số mol
A. CO và 0,5 mol
B. CO2 và 0,5 mol
C. C và 0,2 mol
D. CO2 và 0,054 mol
Lời giải
Đáp án: B
nCH4 = V/22,4 = 0,5 (mol)
CH4 + 2O2 → CO2 + 2H2O
0,5 → 0,5 mol
Câu 10: Nung 6,72 g Fe trong không khí thu được sắt (II) oxit. Tính mFeO và VO2
A. 1,344 g và 0,684 l
B. 2,688 l và 0,864 g
C. 1,344 l và 8,64 g
D. 8,64 g và 2,234 ml
Lời giải
Đáp án: C
2Fe + O2 → 2FeO
0,12→0,06→ 0,12 mol
mFeO = 0,12.72 = 8,64 g
VO2 = 0,06.22,4 = 1,344 l
******************
Trên đây là nội dung bài học Hóa học 8 Bài 22: Tính theo phương trình hóa học do THPT Ngô Thì Nhậm biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Tính theo phương trình hóa học. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường THPT Ngô Thì Nhậm
Chuyên mục: Hoá học 8