Hóa học 11 Bài 7: Nitơ được THPT Ngô Thì Nhậm biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 11 Bài 7
Cấu tạo phân tử
– Nhóm VA có cấu hình electron ngoài cùng là: ns2np3.
– Nên vừa thể hiện được tính oxh và tính khử.
– Cấu hình electron của N2: 1s22s22p3.
– CTCT: N ≡ N.
– CTPT: N2.
– Số oxh của N2: -3, 0, +1, +2, +3, +4, +5.
Tính chất vật lý
– Là chất khí không màu, không mùi, không vị, hơi nhẹ hơn không khí (d = 28/29), hóa lỏng ở -196 ºC.
– Nitơ ít tan trong nước, hoá lỏng và hoá rắn ở nhiệt độ rất thấp. Không duy trì sự cháy và sự hô hấp (không độc).
Tính chất hóa học
– Nitơ có các số oxi hoá: -3, 0, +1, +2, +3, +4, +5.
– N2 có số oxi hoá 0 nên vừa thể hiện tính oxi hoá và tính khử.
– Nitơ có EN N = 946 kJ/mol, ở nhiệt độ thường nitơ khá trơ về mặt hóa học nhưng ở nhiệt độ cao hoạt động hơn.
– Nitơ thể hiện tính oxi hóa và tính khử, tính oxi hóa đặc trưng hơn.
1. Tính oxi hoá:
Phân tử nitơ có liên kết ba rất bền, nên nitơ khá trơ về mặt hóa học ở nhiệt độ thường.
a. Tác dụng với hidro
Ở nhiệt độ cao, áp suất cao và có xúc tác. Nitơ phản ứng với hidro tạo amoniac.
b. Tác dụng với kim loại
– Ở nhiệt độ thường nitơ chỉ tác dụng với liti tạo liti nitrua: 6Li + N2 → 2Li3N.
– Ở nhiệt độ cao, nitơ tác dụng với nhiều kim loại: 3Mg + N2 → Mg3N2 (magie nitrua).
Lưu ý: Các nitrua dễ bị thủy phân tạo NH3.
Nitơ thể hiện tính oxi hoá khi tác dụng với nguyên tố có độ âm điện nhỏ hơn.
2. Tính khử
– Ở nhiệt độ cao (3000 ºC) Nitơ phản ứng với oxi tạo nitơ monoxit.
– Ở điều kiện thường, nitơ monoxit tác dụng với oxi không khí tạo nitơ đioxit màu nâu đỏ.
Nitơ thể hiện tính khử khi tác dụng với nguyên tố có độ âm điện lớn hơn.
– Các oxit khác của nitơ: N2O, N2O3, N2O5 không điều chế được trực tiếp từ nitơ và oxi.
Ghi nhớ: Nitơ thể hiện tính khử khi tác dụng với các nguyên tố có độ âm điện lớn hơn. Thể hiện tính oxi hóa khi tác dụng với các nguyên tố có độ âm điện lớn hơn.
Trạng thái tự nhiên
Trong tự nhiên, nito tồn tại ở dạng tự do và dạng hợp chất.
– Ở dạng tự do, nito chiếm 80% thể tích không khí.
– Ở dạng hợp chất, nito có nhiều trong khoáng vật NaNO3 có tên là diêm tiêu natri.
Ngoài ra nito có trong thành phần của protein, axit ucleic, … và nhiều hợp chất hữu khác.
Ứng dụng và điều chế
1. Ứng dụng
– Nitơ là thành phần dinh dưỡng chính của thực vật.
– Tổng hợp amoniac để điều chế phân đạm, axit nitric …
– Được dùng làm môi trường trơ trong công nghiệp.
– Nitơ lỏng được dùng để bảo quản máu và các mẫu sinh học khác.
2. Điều chế.
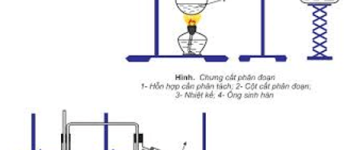
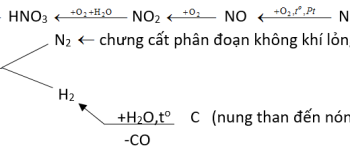
a. Trong công nghiệp
Chưng cất phân đoạn không khí lỏng, thu nitơ ở -196 ºC, vận chuyển trong các bình thép, nén dưới áp suất 150 at.
b. Trong phòng thí nghiệm
Đun dung dịch bão hòa muối amoni nitrit (Hỗn hợp NaNO2 và NH4Cl):
Giải bài tập SGK Hóa học 11 Bài 7
Bài 1 (trang 31 SGK Hóa 11)
Trình bày cấu tạo của phân tử N2? Vì sao ở điều kiện thường nitơ là một chất trơ? Ở điều kiện nào nitơ trở nên hoạt động hơn?
Lời giải:
– Cấu hình e của nitơ: 1s22s22p3
CTCT của phân tử nitơ: N ≡ N
– Giữa hai nguyên tử trong phân tử N2 hình thành một liên kết ba bền vững. Mỗi nguyên tử ni tơ trong phân tử N2 có 8e lớp ngoài cùng, trong sđó có ba cặp e dùng chung và 1 cặp e dùng riêng đã ghép đôi.
Ở điều kiện thường nitơ là chất trơ vì có lên kết ba bền vững giữa hai nguyên tử, liên kết này chỉ bị phân huỷ rõ rệt thành nguyên tử ở nhiệt độ 3000oC.
Ở nhiệt độ cao nitơ trở nên hoạt động vì phân tử N2 phân huỷ thành nguyên tử nitơ có 5e lớp ngoài cùng và có độ âm điện tương đối lớn (3,04) nên trở nên hoạt động.
Bài 2 (trang 31 SGK Hóa 11)
Nitơ không duy trì sự hô hấp, nitơ có phải khí độc không?
Lời giải:
Nitơ không phải là khí độc mặc dù không duy trì sự hô hấp và sự cháy.
Bài 3 (trang 31 SGK Hóa 11)
a. Tìm các cặp công thức đúng của liti nitrua và nhóm nitrua:
A. LiN3 và Al3N
B. Li3N và AlN
C. Li2N3 và Al2N3
D. Li3N2 và Al3N2
b. Viết phương trình hoá học của phản ứng tạo thành liti nitrua và nhóm nitrua khi cho liti và nhôm tác dụng trực tiếp với nitơ. Trong các phản ứng này nitơ là chất oxi hoá hay chất khử?
Lời giải:
a. Đáp án B
Khi liên kết với kim loại nitơ dễ nhận thêm 3e (N có 5e lớp ngoài cùng nên có số oxi hoá -3 còn Li dễ nhường 1e và Al dễ nhường 3e nên lần lượt có số oxi hoá là +1 và +3)
b.
Ta thấy trong các phản ứng trên nitơ là chất oxi hoá vì
Bài 4 (trang 31 SGK Hóa 11)
Nguyên tố nitơ có số oxi hoá là bao nhiêu trong các hợp chất sau: NO, NO2, NH3, NH4Cl, N2O, N2O3, N2O5, Mg3N2?
Lời giải:
Trong các hợp chất trên, số oxi hoá của nitơ lần lượt là: +2, +4, -3, -3, +1, +3, +5, -3.
Bài 5 (trang 31 SGK Hóa 11)
Cần bao nhiêu lít khí nitơ và khí hiđro để điều chế được 67,2 lit khí amoniac? Biết rằng thể tích của các khí đề được đo ở cùng điều kiện nhiệt độ, áp suất và hiệu suất của phản ứng là 25%?
Lời giải:
Ta thấy tỉ lệ về thể tích cùng là tỉ lệ về số mol:
Tỉ lệ số mol cũng chính là tỉ lệ thể tích
Theo pt:
Do hiệu suất của phản ứng là 25% nên thể tích của nitơ và hiđro cần lấy là:
Trắc nghiệm Hóa học 11 Bài 7 có đáp án
Bài 1: Nung nóng 4,8 gam Mg trong bình phản ứng chứa 1 mol khí N2. Sau một thời gian, đưa bình về nhiệt độ ban đầu, thấy áp suất khí trong bình giảm 5% so với áp suất ban đầu. Thành phần phần trăm Mg đã phản ứng là
A. 37,5%.
B. 25,0%.
C. 50%.
D. 75%.
Lời giải
Đáp án: D
Trong bình phản ứng cùng thể tích nhiệt độ do đó áp suất tỉ lệ với số mol, áp suất bình giảm 5% so với ban đầu ⇒ nN2 pư = 5% ban đầu = 0,05 mol
3Mg + N2 -toC→ Mg3N2
nMg = 3nN2 = 0,15
Bài 2: Hỗn hợp N2 và H2 trong bình phản ứng ở nhiệt độ không đổi. Sau thời gian phản ứng, áp suất các khí trong bình thay đổi 5% so với áp suất ban đầu. biết rằng số mol N2 đã phản ứng là 10%. Thành phần phần trăm số mol N2 trong hỗn hợp ban đầu là
A. 20%.
B. 25%.
C. 10%.
D. 5%.
Lời giải
Đáp án: D
N2 + 3H2 -toC→ 2NH3
Áp suất thay đổi 5% so với áp suất ban đầu
Giả sử trước phản ứng có 1 mol ⇒ sau phản ứng có 0,95 mol
ntrước – nsau = 2nN2 pư = 0,05 mol
nN2 ban đầu = 0,025 : 10% = 0,25 ⇒ %nN2 = 25%
Bài 3: Hỗn hợp khi X gồm N2 và H2 có tỉ khối hơi so với He bằng 1,8. Đun nóng trong bình kín một thời gian (có bột Fe làm xúc tác) thu được hỗn hợp khí Y có tỉ khối hơn sô với He bằng 2. Hiệu suất phản ứng tổng hợp NH3 là
A. 10%.
B. 20%.
C. 25%.
D. 5%.
Lời giải
Đáp án: C
MX = 4.1,8 = 7,2
Xét 1 mol hỗn hợp gồm a mol N2 và b mol H2:
a + b = 1; 28a + 2b = 7,2 ⇒ a = 0,2; b = 0,8 (mol)
N2 + 3H2 → 2NH3
nY = 1 – 2a
Mà MY = 4.2 = 8; mY = mX = 7,2 ⇒ nY = 0,9 = 1 – 2a
⇒ a = 0,05 (mol). Vậy H = (0,05/0,2). 100% = 25%
Bài 4: Người ta sản xuất khi nitơ trong công nghiệp bằng cách nào sau đây?
A. Chưng cất phân đoạn không khí lỏng.
B. Nhiệt phân dung dịch NH4NO2bão hoà.
C. Dùng photpho để đốt cháy hết oxi không khí.
D. Cho không khí đi qua bột đồng nung nóng
Lời giải
Đáp án: A
Bài 5: Hiệu suất của phản ứng giữa N2 và H2 tạo thành NH3 tăng nếu
A. giảm áp suất, tăng nhiệt độ.
B. giảm áp suất, giảm nhiệt độ.
C. tăng áp suất, tăng nhiệt độ.
D. tăng áp suất, giảm nhiệt độ.
Lời giải
Đáp án: D
Chiều thuận của phản ứng có tổng số mol khí giảm ⇒ muốn tăng hiệu suất thì tăng áp suất
Chiều thuận của phản ứng là chiều tỏa nhiệt ⇒ tăng hiệu suất thì giảm nhiệt độ
Bài 6: Trong phòng thí nghiệm có thể điều chế N2 bằng cách
A. Nhiệt phân NaNO2
B. Đun hỗn hợp NaNO2và NH4Cl
C. Thủy phân Mg3N2
D. Phân hủy khí NH3
Lời giải
Đáp án: B
Bài 7: Trong phản ứng nào sau đây, nitơ thể hiện tính khử ?
A. N2+ 3H2→ 2NH3
B. N2+ 6Li → 2Li3N
C. N2+ O2→ 2NO
D. N2+ 3Mg → Mg3N2
Lời giải
Đáp án: C
Bài 8: Khí N2 tác dụng với dãy chất nào sau đây:
A. Li, CuO và O2
B. Al, H2và Mg
C. NaOH, H2và Cl2
D. HI, O3và Mg
Lời giải
Đáp án: B
Bài 9: Hỗn hợp X gồm N2 và H2 có MX = 12,4. Dẫn X đi qua bình đựng bột Fe rồi nung nóng biết hiệu suất tổng hợp NH3 đạt 40% thì thu được hỗn hợp Y. MY có giá trị là :
A. 15,12
B. 18,23
C. 14,76
D. 13,48
Lời giải
Đáp án: C
Áp dụng sơ đồ đường chéo cho hỗn hợp N2 và H2 ta có :
Với tỉ lệ trên suy ra H2 thiếu, hiệu suất phản ứng tính theo H2.
Trong hỗn hợp X ta chọn
Số mol H2 phản ứng là 3.40% = 1,2 mol, suy ra số mol N2 phản ứng là 0,4 mol, số mol NH3 sinh ra là 0,8 mol. Sau phản ứng số mol khí giảm là (1,2 + 0,4) – 0,8 = 0,8 mol.
Sau phản ứng số mol khí giảm là 0,8 mol nên: nY = nX – 0,8 = 2 + 3 – 0,8 = 4,2 mol
Theo định luật bảo toàn khối lượng ta có: mY = mX = mN2 + mH2 = 2.28 + 3.2 = 62 gam
Vậy
Bài 10: Một bình kín có thể tích là 0,5 lít chứa 0,5 mol H2 và 0,5 mol N2, ở nhiệt độ (toC). Khi ở trạng thái cân bằng có 0,2 mol NH3 tạo thành. Hằng số cân bằng KC của phản ứng tổng hợp NH3 là :
A. 1.278
B. 3,125
C. 4.125
D. 6,75
Lời giải
Đáp án: B
Theo giả thiết ta thấy ban đầu [H2] = [N2] = 1M.
Thực hiện phản ứng tổng hợp NH3 đến thời điểm cân bằng [NH3] = 0,4M
Phương trình phản ứng hoá học :
Theo (1) tại thời điểm cân bằng [NH3] = 0,8M; [H2] = 0,4M; [NH3] = 0,4M.
Vậy hằng số cân bằng của phản ứng tổng hợp NH3 là :
Bài 11: Cấu hình electron nguyên tử của nitơ là
A. 1s22s22p1.
B. 1s22s22p5.
C. 1s22s22p63s23p2.
D. 1s22s22p3.
Lời giải
Đáp án: D
Bài 12: Khi có tia lửa điện hoặc ở nhiệt độ cao, nitơ tác dụng trực tiếp với ôxi tạo ra hợp chất X. Công thức của X là
A. N2O.
B. NO2.
C. NO.
D. N2O5.
Lời giải
Đáp án: C
Bài 13: Nitơ thể hiện tính khử trong phản ứng với chất nào sau đây ?
A. H2.
B. O2.
C. Mg.
D. Al.
Lời giải
Đáp án: B
Bài 14: Có thể thu được nitơ từ phản ứng nào sau đây ?
A. Đun nóng dung dịch bão hòa natri nitrit với amoni clorua.
B. Nhiệt phân muối bạc nitrat.
C. Cho bột Cu vào dung dịch HNO3đặc nóng.
D. Cho muối amoni nitrat vào dung dịch kiềm.
Lời giải
Đáp án: A
Bài 15: Ở nhiệt độ thường, khí nitơ khá trơ về mặt hóa học. Nguyên nhân là do
A. trong phân tử N2có liên kết ba rất bền.
B. trong phân tử N2, mỗi nguyên tử nitơ còn 1 cặp electron chưa tham gia liên kết.
C. nguyên tử nitơ có độ âm điện kemms hơn oxi.
D. nguyên tử nitơ có bán kính nhỏ.
Lời giải
Đáp án: A
******************
Trên đây là nội dung bài học Hóa học 11 Bài 7: Nitơ do THPT Ngô Thì Nhậm biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Nitơ. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường THPT Ngô Thì Nhậm
Chuyên mục: Hoá học 11

Để lại một bình luận