Hóa học 11 Bài 16: Hợp chất của cacbon được THPT Ngô Thì Nhậm biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 11 Bài 16
Cacbon oxit (CO)
Cấu tạo phân tử và tính chất vật lí
– Cấu tạo của CO là C≡O (trong đó có 1 liên kết thuộc kiểu cho – nhận).
– CO là chất khí, không màu, không mùi, không vị, tan rất ít trong nước và rất bền với nhiệt.
– CO là khí độc vì nó kết hợp với hemoglobin ở trong máu tạo thành hợp chất bền làm cho hemoglobin mất tác dụng vận chuyển khí O2.
Tính chất hóa học
– Phân tử CO có liên kết ba bền vững nên ở nhiệt độ thường C rất trơ, chỉ hoạt động trong điều kiện nhiệt độ cao.
– CO là oxit trung tính không có khả năng tạo muối → không tác dụng với dung dịch bazơ và dung dịch axit ở nhiệt độ thường.
– CO là chất khử mạnh.
+ Tác dụng với các phi kim:
2CO + O2 → 2CO2 (700ºC)
CO + Cl2 → COCl2 (photgen)
+ CO khử oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại (phản ứng xảy ra ở nhiệt độ cao).
3CO + Fe2O3 → 3CO2 + 2Fe
CO + CuO → CO2 + Cu
Điều chế
Bạn đang xem: Hóa học 11 Bài 16: Hợp chất của cacbon – Giải bài tập SGK Hóa học 11 Bài 16
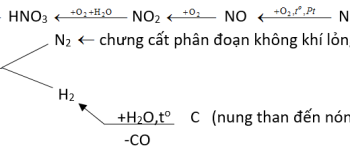
– Trong công nghiệp: Khí CO được điều chế theo hai phương pháp:
+ Khí than ướt
+ Khí lò gas
– Trong phòng thí nghiệm:
HCOOH → CO + H2O (H2SO4 đặc, tº)
Cacbon đioxit (CO2)
Cấu tạo phân tử và tính chất vật lý
1. Cấu tạo phân tử
– Cấu tạo của CO2 là O=C=O.
2. Tính chất vật lý
– Là chất khí không màu, nặng gấp 1,5 lần không khí.
– Tan ít trong nước.
– CO2 khi bị làm lạnh đột ngột là thành phần chính của nước đá khô. Nước đá khô không nóng chảy mà thăng hoa nên được dùng để làm môi trường lạnh và khô, rất tiện lợi để bảo quản thực phẩm.
Tính chất hóa học
– Khí CO2 không cháy, không duy trì sự cháy của nhiều chất.
1. CO2 là oxit axit
– CO2 tan trong nước tạo thành axit cacbonic (là một điaxit rất yếu):
CO2 (k) + H2O (l) ⇋ H2CO3 (dd)
– CO2 tác dụng với oxit bazơ → muối:
CaO + CO2 → CaCO3 (tº)
– CO2 tác dụng với dung dịch kiềm → muối + (H2O)
NaOH + CO2 → NaHCO3
2NaOH + CO2 → Na2CO3 + H2O
Phản ứng của CO2 với dung dịch kiềm tạo thành muối nào tuỳ thuộc vào tỉ lệ số mol của 2 chất tham gia phản ứng.
2. CO2 bền, ở nhiệt độ cao bị nhiệt phân một phần và tác dụng được với các chất khử mạnh
2CO2 ⇋ 2CO + O2 (tº)
CO2 + 2Mg → 2MgO + C
(Đây là nguyên nhân không sử dụng CO2 để dập tắt các đám cháy kim loại)
CO2 + C → 2CO
3. CO2 còn được dùng để sản xuất ure.
CO2 + 2NH3 → NH4O-CO-NH2 (amoni cacbamat)
NH4O-CO-NH2 → H2O + (NH2)2CO (180ºC; 200at)
Điều chế
– Quá trình hô hấp của người và động vật:
C6H12O6 + 6O2 → 6CO2 + 6H2O
– Quá trình lên men bia rượu:
C6H12O6 → 2CO2 + 2C2H5OH
– Quá trình đốt cháy nhiên liệu:
CxHy + (x + y/4)O2 → xCO2 + y/2 H2O
– Trong công nghiệp:
C + O2 → CO2 (đốt cháy hoàn toàn than cốc trong không khí)
CaCO3 → CaO + CO2 (1000ºC)
– Trong phòng thí nghiệm:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Axit Cacbonic và muối Cacbonat
Axit Cacbonic (H2CO3)
– Là axit kém bền, chỉ tồn tại trong dung dịch loãng, dễ bị phân hủy thành CO2 và H2O.
– Là axit hai nấc, trong dung dịch phân li hai nấc.
H2CO3 ⇋ H+ + HCO3-
HCO3- ⇋ H+ + CO32-
Muối Cabonat
Là muối của axit cacbonic (gồm muối CO32- và HCO3-).
1. Tính tan
– Muối cacbonat của các kim loại kiềm, amoni và đa số muối hiđrocacbonat đều tan. Muối cacbonat của kim loại khác thì không tan.
2. Tính chất hóa học
– Tính chất hóa học chung của muối:
+ Tác dụng với axit → muối mới + CO2 + H2O
NaHCO3 + HCl → NaCl + CO2↑ + H2O
HCO3- + H+ → CO2↑ + H2O
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
CO32- + 2H+ → CO2↑ + H2O
Chú ý:
Nếu cho H+ vào muối tan thì CO32- → HCO3- → H2O + CO2.
Nếu cho H+ vào muối không tan thì CO32- → CO2 + H2O.
+ Tác dụng với dung dịch kiềm → muối mới + bazơ mới.
NaHCO3 + NaOH → Na2CO3 + H2O
+ Tác dụng với muối → 2 muối mới.
Na2CO3 + CaCl2 → CaCO3 + 2NaCl
+ Tác dụng với kim loại đứng trước kim loại tạo muối → muối mới + kim loại mới.
Cu(HCO3)2 + Mg → Mg(HCO3)2 + Cu
– Phản ứng thủy phân: Muối cacbonat của kim loại kiềm bị thủy phân mạnh tạo môi trường kiềm:
Na2CO3 → 2Na+ + CO32-
CO32- + H2O ⇋ HCO3- + OH-
→ Trong một số phản ứng trao đổi Na2CO3 đóng vai trò như 1 bazơ:
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3 + 6NaCl + 3CO2
Chú ý: Muối (NH4)2CO3 có môi trường trung tính.
– Phản ứng nhiệt phân:
+ Muối cacbonat tan không bị nhiệt phân (trừ muối amoni), muối cacbonat không tan bị nhiệt phân:
MgCO3 → MgO + CO2 (tº)
+ Tất cả các muối hiđrocacbonat đều bị nhiệt phân:
2NaHCO3 → Na2CO3 + CO2 + H2O
Ca(HCO3)2 → CaCO3 + H2O + CO2
3. Nhận biết
Cho tác dụng với axit → CO2
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
4. Tính chất và ứng dụng của một số muối cacbonat
– Canxi cacbonat (CaCO3) tinh khiết là chất bột nhẹ, màu trắng, dùng làm chất dộn trong cao su và 1 số ngành công nghiệp.
– Natricacbonat (Na2CO3) khan (sođa khan) là chất bột màu trắng, tan nhiều trong nước. Dùng trong công ngiệp thủy tinh, đồ gốm, bột giặt, …
– Natri hidrocacbonat (NaHCO3) là chất tinh thể màu trắng, hơi ít tan trong nước. Dùng trong công nghiệp thực phẩm, trong y học dùng làm thuốc giảm đau dạ dày.
Giải bài tập SGK Hóa học 11 Bài 16
Bài 1 (trang 75 SGK Hóa 11)
Làm thế nào để loại hơi nước và khí CO2 có lẫn trong khí CO ? Viết các phương trình hóa học?
Lời giải:
– Dẫn hỗn hợp khí đi qua dung dịch nước vôi trong dư, khí cacbonic sẽ bị giữ lại
CO2 + Ca(OH)2 → CaCO3 + H2O
– Còn lại hơi nước và CO ta dẫn qua bình H2SO4 đặc thì hơi nước bị giữ lại, ta thu được khí CO.
Bài 2 (trang 75 SGK Hóa 11)
Có ba chất gồm CO, HCl và SO2 đựng trong ba bình riêng biệt. Trình bày phương pháp hóa học để nhận biết từng chất khí. Viết các phương trình hóa học.
Lời giải:
– Để cánh hoa hồng lên miệng từng ống nghiệm, ống nào làm nhạt màu cánh hoa hồng là SO2.
– Dẫn hai khí còn lại qua dung dịch AgNO3 nếu thấy xuất hiện kết tủa màu trắng là khí HCl, nếu không thấy hiện tượng gì là CO.
HCl + AgNO3 → AgCl↓ + HNO3
Bài 3 (trang 75 SGK Hóa 11)
Điều nào sau đây không đúng cho phản ứng của khí CO và O2?
A. Phản ứng thu nhiệt.
B. Phản ứng tỏa nhiệt.
C. Phản ứng kèm theo sự giảm thể tích.
D. Phản ứng không xảy ra ở điều kiện thường.
Lời giải:
Đáp án A
Bài 4 (trang 75 SGK Hóa 11)
a. Khi đun nóng dung dịch canxi hidrocacbonat thì có kết tủa xuất hiện. Tổng các hệ số tỉ lượng trong phương trình hóa học của phản ứng là:
A. 4
B. 5
C. 6
D. 7
b. Khi cho dư khí CO2 vào dung dịch chứa kết tủa canxi cacbonat, thì kết tủa sẽ tan. Tổng các hệ số tỉ lượng trong phương trình hóa học của phản ứng là:
A. 4
B. 5
C. 6
D. 7
Lời giải:
(Hệ số tỉ lượng của phản ứng hóa học là số chỉ số nguyên tử, phân tử và ion của các chất tham gia tương tác được ghi trong phương trình phản ứng hóa học. Hay nói cách khác thì đó chính là các hệ số cân bằng trong phương trình hóa học.)
a. Đáp án A
Ca(HCO3)2 CaCO3 + CO2 + H2O
⇒ Tổng hệ số = 1 + 1 + 1 + 1 = 4
b. Đáp án A
CaCO3 + CO2 + H2O → Ca(HCO3)2
⇒ Tổng hệ số = 1 + 1 + 1 + 1 = 4
Bài 5 (trang 75 SGK Hóa 11)
Cho 224,0 ml CO2 (đktc) hấp thụ hết trong 100,0ml dung dịch kali hidroxit 0,200 M. Tính khối lượng của những chất có trong dung dịch tạo thành.
Lời giải:
Ta có tỉ lệ:
⇒ Phương trình tạo muối trung hoà
CO2 + 2KOH → K2CO3 + H2O
⇒ Dung dịch sau phản ứng có
mK2CO3 = 0,01.138 = 1,38 g
Bài 6 (trang 75 SGK Hóa 11)
Nung 52,65 g CaCO3 ở 100oC và cho toàn bộ lượng khí thoát ra hấp thụ hết vào 500,0 ml dung dịch NaOH 1,800M. Hỏi thu được những muối nào? Khối lượng là bao nhiêu? Biết rằng hiệu suất phản ứng nhiệt phân CaCO3 là 95%.
Lời giải:
nNaOH = 1,8.0,5 = 0,9(mol)
CaCO3 → CaO + CO2
Từ phương trình suy ra:
nCO2 = nCaCO3 = 0,5265 (mol)
Do hiệu suất phản ứng là 95% nên
⇒ nCO2 thực tế = 95%.0,5265 = 0,500175 (mol)
⇒ Tạo ra hỗn hợp 2 muối
Ta có hệ phương trình:
⇒ mNa2CO3 = 0,399825.106 = 42,378 gam
mNaHCO3 = 0,10035.84 = 8,43 gam
Trắc nghiệm Hóa học 11 Bài 16 có đáp án
Bài 1: Trong bình kín chứa 0,5 mol CO và m gam Fe3O4. Đun nóng bình cho tới khi phản ứng xảy ra hoàn toàn thì khí trong bình có tỉ khối so với khí CO ban đầu là 1,457. Giá trị của m là
A. 17,4.
B. 11,6.
C. 22,8.
D. 23,2.
Lời giải
Đáp án: D
Khí trong bình sau phản ứng có CO2 và CO ( dư)
CO + [O] → CO2
x → x → x (mol)
Sau phản ứng: nCO = 0,5 – x; nCO2 = x ⇒ nkhí sau = 0,5 mol
Ta có: mCO2 + mCO = 44x + 28(0,5 – x) = 1,457.28.0,5
⇒ x = 0,4 ⇒ nO(Fe3O4) = 0,4 ⇒ nFe3O4 = 0,1 mol
⇒ m = 23,2 gam
Bài 2: Cho hơi nước đi qua than nóng đỏ được hỗn hợp khí X gồm CO2, CO và H2. Toàn bộ lượng X khử vừa hết 48 gam Fe2O3 thành Fe và thu được 10,8 gam H2O. thành phần phần trăm thể tích CO2 trong X là
A. 13,235%.
B. 16,135%.
C. 28,571%.
D. 14,286%.
Lời giải
Đáp án: D
nFe2O3 = 0,3 mol ⇒ nO = 0,9 mol;
nH2O = 0,6 mol; ⇒ nH2 = 0,6 mol ⇒ nH2O ban đầu = 0,6 mol
H2 + [O]Fe3O4 → H2O
CO + [O]Fe3O4 → CO2
Bảo toàn oxi: nO (Fe3O4) = nH2 + nCO = 0,9
⇒ nCO = 0,3 mol
C + [O]H2O → CO
C + [O]H2O → CO2
Bảo toàn oxi: nO(H2O ban đầu) = nO (CO2) + nO (CO) = 0,6
⇒ nCO2 = 0,15 mol
Bài 3: Cho hỗn hợp khí gồm CO2 và CO. dùng chất nào sau đây có thể thu được CO2 tinh khiết hơn ?
A. dung dịch NaOH
B. CuO (tocao)
C. O2
D. dung dịch BaCl2
Lời giải
Đáp án: B
Bài 4: Na2CO3 lẫn tạp chất là NaHCO3. Cách nào sau đây có thể thu được Na2CO3 tinh khiết ?
A. hòa tan vào nước rồi lọc
B. nung nóng
C. cho tác dụng với NaOH dư
D. cho tác dụng với dung dịch Ca(OH)2dư
Lời giải
Đáp án: B
Bài 5: Từ hai muối X và Y thực hiện các phản ứng sau :
X → Y + CO2 X1 + H2O → X2
X2 + Y → X + Y1 + H2O X2 + 2Y → X + Y2 + 2H2O
Hai muối X, Y tương ứng là
A. CaCO3, NaHSO4.
B. BaCO3, Na2CO3.
C.CaCO3, NaHCO3.
D. MgCO3, NaHCO3.
Lời giải
Đáp án: C
Bài 6: Cho bốn chất rắn sau : NaCl, Na2CO3, CaCO3, BaSO4. Chỉ dùng thêm một cặp chất nào dưới đây có thể nhận biết được bốn chất rắn trên ?
A. H2O và CO2
B. H2O và NaOH
C. H2O và HCl
D. H2O và BaCl2
Lời giải
Đáp án: C
Bài 7: Hấp thụ hết 1,792 lít (đktc) khí CO2 vào 1 lít dung dịch NaOH aM thu được dung dịch X . Cho X vào dung dịch BaCl2 dư thu được 7,88 gam kết tủa. Giá trị của a là
A. 0,08
B. 0,12
C. 0,16
D. 0,10.
Lời giải
Đáp án: B
nCO2 = 0,08 mol; nNa2CO3 = nCO32- = nBaCO3 = 0,04 < nCO2
⇒ Trong X có HCO3-
Bảo toàn C ⇒ nNaHCO3 = nHCO3- = 0,08 – 0,04 = 0,04
Bảo toàn Na: nNaOH = 2nNa2CO3 + nNaHCO3 = 0,12 mol ⇒ a = 0,12
Bài 8: hấp thụ hoàn toàn 3,584 lít CO2 (đktc) vào 2 lít dung dịch Ca(OH)2 0,05M được kết tủa X và dung dịch Y. So với dung dịch Ca(OH)2 ban đâì thì khối lượng dung dịch Y
A. tăng 7,04 gam.
B. giảm 3,04 gam.
C. giảm 4 gam.
D. tăng 3,04 gam.
Lời giải
Đáp án: D
nCO2 = 0,16 mol; nOH- = 0,2 mol
⇒ Tạo 2 muối, nHCO3- = 0,12 mol; nCO32- = 0,04 mol
mCO2 = 7,04g; mCaCO3 = 4g
⇒ mdung dịch tăng = 7,04 – 4 = 3,04 gam
Bài 9: Sục V lít CO2 (đktc) vào 200 ml dung dịch X gồm Ba(OH)2 1M và NaOH 1M. Sau phản ứng thu được 19,7 gam kết tủa. Giá trị của V là
A. 2,24 hoặc 4,48
B. 2,24 hoặc 11,2
C. 6,72 hoặc 4,48
D. 5,6 hoặc 11,2.
Lời giải
Đáp án: B
nBa(OH)2 = nNaOH = 0,2; nBaCO3 = 0,1
Trường hợp 1: CO2 hết, Ba(OH)2 dư ⇒nCO2 = nBaCO3 = 0,1 ⇒ V = 2,24 lít
Trường hợp 2: CO2 hết, Ba(OH)2 hết
⇒ nCO2 = nOH- – 0,1 = 0,6 – 0,1 = 0,5 ⇒ V = 11,2 lít
Bài 10: Cho từ từ 100 ml dung dịch HCl 1,5M vào 100 ml dung dịch hỗn hợp gồm Na2CO3 1M và KHCO3 1M, thu được V lít khí CO2 (đktc). Giá trị của V là
A. 1,12.
B. 3,36
C. 1,68
D. 2,24
Lời giải
Đáp án: D
Nhỏ từ từ H+ vào HCO3- và CO32-, sẽ phản ứng đồng thời theo tỉ lệ của 2 muối.
3H+ + HCO3- + CO32- → 2CO2 + 2H2O
nHCl = 0,15 mol; nCO32- = nHCO3- = 0,1 mol
⇒ H+ hết, nCO2 = 0,1 mol ⇒ V = 2,24 lít
Bài 11: Phản ứng nào sau đây được sử dụng để điều chế CO trong phòng thí nghiệm
A. HCOOH (xt H2SO4đặc) → H2O + CO
B. C + H2O (hơi) → CO + H2
C. C + CO2→ 2CO
D. 2C + O2→ CO
Lời giải
Đáp án: A
Bài 12: Quặng nào sau đây chứa CaCO3 ?
A. dolomit.
B. cacnalit.
C. pirit.
D. xiderit.
Lời giải
Đáp án: A
Bài 13: CO không khử được các oxit trong nhóm nào sau đây ?
A. Fe2O3, MgO
B. MgO, Al2O3
C. Fe2O3, CuO
D. ZnO, Fe2O3,
Lời giải
Đáp án: B
Bài 14: Nhóm nào sau đây gồm các muối không bị nhiệt phân ?
A. CaCO3, Na2CO3, KHCO3
B. Na2CO3, K2CO3, Li2CO3
C. Ca(HCO3)2, Mg(HCO3)2, KHCO3
D. K2CO3, KHCO3, Li2CO3
Lời giải
Đáp án: B
Bài 15: Phản ứng nào sau đây được sử dụng để điều chế CO2 trong phòng thí nghiệm
A. CaCO3+ HCl
B. CaCO3(to cao)
C. C + O2(tocao)
D. CO + O2 (to cao)
Lời giải
Đáp án: A
Bài 16: Một loại đá vôi chứa 80% CaCO3 còn lại là tạp chất trơ. Nung m gam đá này một thời gian thu được 0,78m gam chất rắn. Hiệu suất phân hủy CaCO3 là
A. 78%.
B. 50%.
C. 62,5%.
D. 97,5%.
Lời giải
Đáp án: C
mCaCO3 = 0,8m
CaCO3 → CaO + CO2
44a = m – 0,78m ⇒ a = 0,005m
Bài 17: Nung 34,6 gam hỗn hợp gồm Ca(HCO3)2, NaHCO3 và KHCO3, thu được 3,6 gam H2O và m gam hỗn hợp các muối cacbonat. Giá trị của m là
A. 31,0.
B. 22,2.
C. 17,8.
D. 26,6.
Lời giải
Đáp án: B
nH2O = nCO2 = 0,2 mol
mmuối cacbonat = mhỗn hợp – mCO2 – mH2O = 34,6 – 0,2.44 – 3,6 = 22,2 gam
Bài 18: Cho 11,6 gam hỗn hợp gồm oxit và muối cacbonat của kim loại kiềm R. Hòa tan hết hỗn hợp trên cần vừa đủ 0,2 mol HCl. Kim loại R là
A. Na.
B. Li.
C. Cs.
D. K.
Lời giải
Đáp án: D
R2O (x mol); R2CO3 (y mol)
⇒ (2R + 16).x + (2R + 60).y = 11,6 (1)
nHCl = 2nR2O + 2nR2CO3 = 0,2 ⇒ x + y = 0,1 mol (2)
Từ (1)(2) ⇒ 2R + 16 < 11,6/0,1 < 2R + 60
⇒ 28 < R < 50 ⇒ R = 39 (Kali)
******************
Trên đây là nội dung bài học Hóa học 11 Bài 16: Hợp chất của cacbon do THPT Ngô Thì Nhậm biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Hợp chất của cacbon. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường THPT Ngô Thì Nhậm
Chuyên mục: Hoá học 11