Hóa 8 bài 43: Cách Pha chế dung dịch theo nồng đồ cho trước và Cách tính để pha loãng dung dịch. Chúng ta đã biết cách tính nồng độ dung dịch (nồng độ phần trăm, nồng độ mol) qua bài học trước, trong bài học này chúng ta sẽ tìm hiểu cách pha chế dung dịch.
Vậy pha chế một dung dịch theo nồng độ cho trước hay pha loãng một dung dịch theo nồng độ cho trước được thực hiện như thế nào? chúng ta hãy cùng tìm hiểu qua bài viết này.
I. Cách pha chế dung dịch theo nồng độ cho trước
• Có 2 kiểu pha chế:
– Pha chế dung dịch theo nồng độ phần trăm
– Pha chế dung dịch theo nồng độ mol
• Dù cách pha chế nào ta cũng cần xác định được chất nào là chất tan, chất nào là dung môi.
* Bài tập 1: Từ muối CuSO4, nước cất và các dụng cụ cần thiết, hãy tính toán và giới thiệu cách pha chế
a) 50 gam dung dịch CuSO4 10%.
b) 50 ml dung dịch CuSO4 1M
° Lời giải:
a) 50 gam dung dịch CuSO4 10%.
• Tính toán:
– Tính khối lượng chất tan
mCuSO4 = (C%.mdd)/100% = (10%.50)/100% = 5(g).
– Từ công thức: mdung dịch = mdung môi + mchất tan
⇒ mdung môi = mdung dịch – mchất tan = 50 – 5 = 45 (g)
⇒ Vậy khối lượng nước cần dùng cho sự pha chế là 45 (g).
• Cách pha chế:
– Cân lấy 5g CuSO4 khan (màu trắng) cho vào cốc có dung tích 100ml.
– Cân lấy 45g (hoặc đong lấy 45 ml) nước cất, rồi đổ dần dần vào cốc và khấy nhẹ, được 50g dung dịch CuSO4 10%.
b) 50 ml dung dịch CuSO4 1M
• Tính toán: (có 50 ml = 50/1000 lít)
– Tính số mol chất tan, từ công thức: nên
– Khối lượng của 0,05mol CuSO4 là:
⇒ Vậy khối lượng CuSO4 cần thêm vào là 8g để tạo 50ml dung dịch CuSO4 1M.
• Cách pha chế:
– Cân lấy 8g CuSO4 cho vào cốc thủy tính có dung tích 100ml. Đổ dàn dần nước cất vào cốc và khuấy nhẹ cho đủ 50ml dung dịch. Ta được 50ml dung dịch CuSO4 1M.
II. Cách pha loãng một dung dịch theo nồng độ cho trước
* Bài tập 2: Có nước cất và những dụng cụ cần thiết hãy tính toán và giới thiệu các cách pha chế:
a) 100 ml dung dịch MgSO4 0,4M từ dung dịch MgSO4 2M.
b) 150 g dung dịch NaCl 2,5% từ dung dịch NaCl 10%.
° Lời giải:
a) 100 ml dung dịch MgSO4 0,4M từ dung dịch MgSO4 2M.
• Tính toán: (100ml = 100/1000 (lít)=0,1 lít)
– Tìm số mol chất tan có trong 100ml dung dịch MgSO4 0,4M.
– Tìm thể tích dung dịch MgSO4 2M trong đó có chứa 0,04mol MgSO4:
• Cách pha chế:
– Đong lấy 20 ml dung dịch MgSO4 2M cho vào cốc chia độ có dung tích 200ml. Thêm từ từ nước cất vào cốc đến vạch 100ml và khuấy đều, ta được 100ml dung dịch MgSO4 0,4M.
b) 150 g dung dịch NaCl 2,5% từ dung dịch NaCl 10%.
• Tính toán:
– Tìm khối lượng NaCl có trong 150g dung dịch NaCl 2,5%
– Tìm khối lượng dung dịch NaCl ban đầu có chứa 3,75g NaCl
– Tìm khối lượng nước cần dùng để pha chế:
mH2O = 150 – 37,5 = 112,5(g)
• Cách pha chế:
– Cân lấy 37,5g dung dịch NaCl 10% ban đầu, sau đó đổ vào cốc hoặc bình tam giác có dung tích vào khoảng 200ml.
– Cân lấy 112,5g nước cất hoặc đong 112,5ml nước cất, sau đó đổ vào cốc đụng dung dịch NaCl nói trên. Khuấy đều, ta được 150g dung dịch NaCl 2,5%.
III. Bài tập về pha chế dung dịch
* Bài 1 trang 149 SGK Hóa 8: Làm bay hơi 60g nước từ dung dịch có nồng độ 15% được dung dịch mới có nồng độ 18%. Hãy xác định khối lượng của dung dịch ban đầu.
° Lời giải bài 1 trang 149 SGK Hóa 8:
– Gọi m là khối lượng dung dịch ban đầu
– Khối lượng dung dịch sau khi làm bay hơi nước là: (m-60)g.
– Khối lượng chất tan trước và sau là không đổi, nên ta có:
⇔ 15.m = 18(m – 60)
⇔ 15m = 18m – 1080
⇔ 3m = 1080
⇔ m = 360 (g)
– Vậy khối lượng dung dịch ban đầu (trước khi bay hơi) là 360(g).
* Bài 2 trang 149 SGK Hóa 8: Đun nhẹ 20g dung dịch CuSO4 cho đến khi nước bay hơi hết, người ta thu được chất rắn màu trắng là CuSO4 khan. Chất này có khối lượng là 3,6g. Hãy xác định nồng độ phần trăm của dung dịch CuSO4.
° Lời giải bài 2 trang 149 SGK Hóa 8:
– Ta có: C%=.100% = .100% = 18%.
– Vậy nồng độ phần trăm của dung dịch CuSO4 là 18%.
* Bài 3 trang 149 SGK Hóa 8: Cân lấy 10,6g Na2CO3 cho cốc chia độ có dung tích 0,5 lít. Rót từ từ nước cất vào cốc cho đến vạch 200ml. Khuấy nhẹ cho Na2CO3 tan hết, ta được dung dịch. Biết 1ml dung dịch này cho lượng là 1,05g.
Hãy xác định nồng độ phần trăm (C%) và nồng độ mol/l của dung dịch vừa pha chế được.
° Lời giải bài 3 trang 149 SGK Hóa 8:
• Nồng độ % của dung dịch Na2CO3.
mdd = V.d = 200.1,05 = 210g dung dịch Na2CO3.
C%Na2CO3 = (mct/mdd).100% = (10,6/210).100% = 5,05%
• Nồng độ mol/l của dung dịch Na2CO3.
– Ta có: 200ml = 0,2l.
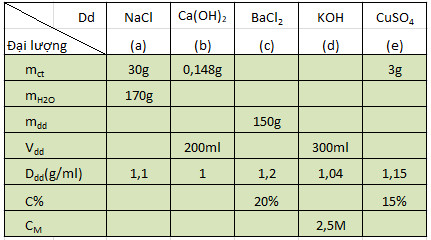
* Bài 4 trang 149 SGK Hóa 8: Hãy điền những giá trị chưa biết vào những ô trống trong bảng, bằng cách thực hiện các tính toán theo mỗi cột.
° Lời giải bài 4 trang 149 SGK Hóa 8:
• Dung dịch NaCl:
mdd = 30 + 170 = 200(g).
V=m/D = 200/1,1 ≈ 182(ml) = 0,182(l).
C% = (mct/mdd).100% = 15%
nNaCl = m/M = 30/58,5 = 0,51(mol)
⇒ CM = n/V = 0,51/0,182 = 2,8M.
• Dung dịch Ca(OH)2:
mdd = V.D = 200(g).
mH2O = mdd – mct = 200 – 0,148 = 199,852(g)
C% = (mct/mdd).100% = (0,148/200).100% = 0,074%
nCa(OH)2 = m/M = 0,148/74 = 0,002(mol)
V= mdd/D = 200/1 = 200ml = 0,2(l).
⇒ CM = n/V = 0,002/0,2 = 0,01M.
• Dung dịch BaCl2:
mdd = mct/C% = 30/0,2 = 150(g).
mH2O = mdd – mct = 150 – 30 = 120(g)
Vdd = mdd/D = 150/1,2 = 125ml = 0,125l.
nBaCl2 = m/M = 30/208 = 0,144(mol)
⇒ CM = n/V = 0,144/0,125 = 1,152M.
• Dung dịch KOH:
nKOH = CM.V = 2,5.0,3 = 0,75(mol)
mct = n.M = 0,75.56 = 42 (g)
mdd = V.D = 300.1,04 = 312(g)
mH2O = mdd – mct = 312 – 42 = 270(g)
⇒ C% = (mct/mdd).100% = (42/312).100% = 13,46%
• Dung dịch CuSO4:
mct = mdd – mH2O = 20 – 17 = 3(g)
C% = (mct/mdd).100% = (3/20).100% = 15%
D = mdd/Vdd = 20/17,39 = 1,15(g/ml)
nCuSO4 = m/M = 3/160 = 0,01875(mol)
⇒ CM = n/V = 0,01875/0,01739 = 1,078M.
* Bài 5 trang 149 SGK Hóa 8: Tìm độ tan của một muối trong nước bằng phương pháp thực nghiệm người ta có được những kết quả sau:
– Nhiệt độ của dung dịch muỗi bão hòa là 20oC.
– Chén sứ nung có khối lượng 60,26g.
– Chén sứ đựng dung dịch muối có khối lượng 86,26 g.
– Khối lượng chén nung và muối kết tinh sau khi làm bay hết hơi nước là 66,26 g.
Hãy xác định độ tan của muối ở nhiệt độ 20oC.
° Lời giải bài 5 trang 149 SGK Hóa 8:
– Ta có: mdd = 86,26 – 60,26 = 26(g)
mct = 66,26 – 60,26 = 6 (g) ⇒ mH2O = 26 – 6 = 20(g)
– Độ tan của muối ở 20°C là:
– Vậy độ tan của muối ở 20°C là 30(g).
Hy vọng với bài viết về Cách Pha chế dung dịch theo nồng đồ cho trước và Cách tính để pha loãng dung dịch ở trên hữu ích cho các em. Mọi góp ý và thắc mắc các em hãy để lại nhận xét dưới bài viết để THPT Ngô Thì Nhậm ghi nhận và hỗ trợ, chúc các em học tốt.
Đăng bởi: THPT Ngô Thì Nhậm
Chuyên mục: Giáo Dục