Hóa học 9 Bài 26: Clo được THPT Ngô Thì Nhậm biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 9 Bài 26
I. TÍNH CHẤT VẬT LÍ
Clo là chất khí , màu vàng lục, mùi hắc, nặng gấp 2,5 lần không khí và tan được trong nước.
Tác dụng sinh lí: Clo là một khí độc.
II. TÍNH CHẤT HÓA HỌC
1. Clo có những tính chất hóa học của phi kim
a) Tác dụng kim loại → muối clorua
Clo phản ứng với với hầu hết kim loại tạo thành muối clorua
Ví dụ:
b) Tác dụng hiđro → khí hiđro clorua
Phương trình hóa học:
Khí hiđro clorua tan nhiều trong nước tạo thành dung dịch axit clohiđric.
Chú ý: Clo không phản ứng trực tiếp với oxi.
2. Tính chất hóa học khác của clo
a) Tác dụng với nước
Phương trình hóa học:
Cl2 (k) + H2O (l) ⇄ HCl (dd) + HClO (dd)
Nước clo là dung dịch hỗn hợp các chất Cl2, HCl, HClO có màu vàng lục, mùi hắc.
Khi cho quỳ tím vào nước clo, lúc đầu dung dịch làm quỳ tím hóa đỏ, sau đó nhanh chóng mất màu do tác dụng oxi hóa mạnh của axit hipoclorơ HClO.
Hình 1: Minh họa cho quỳ tím vào nước clo
Nước clo có tính tẩy màu, sát trùng.
b) Tác dụng với dung dịch kiềm (NaOH, KOH, …)
Ví dụ:
Cl2 + 2NaOH → NaCl + NaClO + H2O
Nước Gia – ven là hỗn hợp hai muối natri clorua (NaCl) và natri hipoclorit (NaClO). Dung dịch này có tính tẩy màu tương tự nước clo.
III. ỨNG DỤNG CỦA CLO
– Nước clo dùng khử trùng nước sinh hoạt.
– Tẩy trắng vải sợi, bột giấy….
– Điều chế nước Gia – ven, clorua vôi…
– Điều chế nhựa PVC, chất dẻo, chất màu…
IV. ĐIỀU CHẾ KHÍ CLO
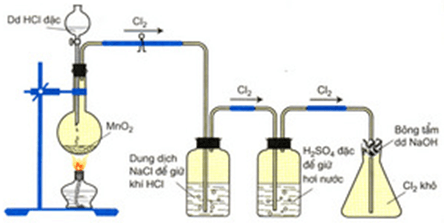
1. Trong phòng thí nghiệm
Phương pháp: Đun nóng nhẹ dung dịch HCl đậm đặc với các chất oxi hóa mạnh như MnO2, KMnO4,…
Ví dụ:
Thu khí clo bằng cách đẩy không khí.
Hình 2: Điều chế clo trong phòng thí nghiệm
2. Trong công nghiệp
Phương pháp: Điện phân dung dịch NaCl bão hòa (có màng ngăn xốp ngăn không cho khí Cl2 thoát ra tác dụng với NaOH tạo thành nước Gia-ven)
Giải bài tập SGK Hóa học 9 Bài 26
Bài 1 (trang 81 SGK Hóa 9)
Khi dẫn khí clo vào nước xảy ra hiện tượng vật lí hay hiện tượng hóa học? Giải thích.
Lời giải:
Dẫn khí clo vào nước, vừa là hiện tượng vật lí, vừa là hiện tượng hóa học, vì:
– Có tạo thành chất mới là HCl và HClO.
– Có khí clo tan trong nước.
Cl2 (k) + H2O (1) ↔ HCl(dd) + HClO(dd).
Bài 2 (trang 81 SGK Hóa 9)
Nếu tính chất hóa học của clo. Viết các phương trình hóa học minh họa.
Lời giải:
Phương trình hóa học của clo.
– Tác dụng với kim loại: 3Cl2 (k) + 2Fe (r ) 2FeCl3(r)
– Tác dụng với hiđro: Cl2 (k) + H2 (k) 2HCl (k)
– Tác dụng với nước: Cl2(k) + H2O ↔ HCl(dd) + HClO(dd).
– Tác dụng với dung dịch NaOH:
Cl2 (k) + 2NaOH(dd) → NaCl(dd) + NaClO(dd) + H2O(1)
Bài 3 (trang 81 SGK Hóa 9)
Viết phương trình hóa học khi cho clo, lưu huỳnh, oxi với sắt ở nhiệt độ cao. Cho biết hóa trị của sắt trong những hợp chất tạo thành.
Lời giải:
a) 2Fe(r) + 3Cl2 → 2FeCl3 (r) (Fe hóa trị III)
b) Fe(r) + S (r) → FeS (r) (Fe hóa trị II )
c) 3Fe (r) + 2O2 → Fe3O4(r) (Fe hóa trị III và II).
Nhận xét:
– Clo đưa Sắt lên hóa trị cao nhất là III trong hợp chất FeCl3
– Trong hợp chất Fe3O4 sắt thể hiện cả hóa trị II và hóa trị III
– Lưu huỳnh tác dụng với Sắt tạo hợp chất FeS, trong đó Fe có hóa trị II. Như vậy mức độ hoạt động của các phi kim được sắp xếp theo chiều giảm dần như sau: Cl, O, S.
Bài 4 (trang 81 SGK Hóa 9)
Sau khi làm thí nghiệm, khí clo dư được loại bỏ bằng cách sục khí clo vào:
a) Dung dịch HCl.
b) Dung dịch NaOH.
c) Dung dịch NaCl.
d) Nước.
Trường hợp nào đúng? Hãy giải thích.
Lời giải:
Trường hợp đúng là b). Vì dung dịch này phản ứng được với khí Clo tạo thành muối.
Cl2 (k) + 2NaOH(dd) → NaCl(dd) + NaClO(dd) + H2O(1)
Bài 5 (trang 81 SGK Hóa 9)
Dẫn khí clo vào dung dịch KOH tạo thành dung dịch hai muối. Viết các phương trình hóa học.
Lời giải:
Phương trình phản ứng:
Cl2 + 2KOH → KCl + KClO + H2O.
Bài 6 (trang 81 SGK Hóa 9)
Có ba khí được đựng riêng biệt trong ba lọ: clo, hiđrua clorua, oxi. Hãy nêu ba phương pháp hóa học để nhận biết từng khí đựng trong ba lọ.
Lời giải:
Lấy mẫu thử từng khí:
– Dùng quỳ tím ẩm cho vào các mẫu thử:
+ Nhận biết được khí clo: làm mất màu giấy quỳ tím ẩm
+ Nhận ra được khí hiđro clorua: làm quỳ tím ẩm hóa đỏ.
+ Không có hiện tượng gì là khí oxi
(Hoặc Dùng tàn đóm ta nhận biết khí oxi: oxi làm tàn đóm bùng cháy.)
Bài 7 (trang 81 SGK Hóa 9)
Nêu phương pháp điều chế clo trong phòng thí nghiệm. Viết phương trình hóa học minh họa.
Lời giải:
– Điều chế khí clo trong phòng thí nghiệm: dùng chất oxi hóa mạnh như: MnO2, KMnO4.
4HCl dd đặc + MnO2 −−đun nhẹ→ MnCl2 + Cl2↑ + 2H2O
16HCl đậm đặc + 2KMnO4 −−đun nhẹ→ 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
Bài 8 (trang 81 SGK Hóa 9)
Trong công nghiệp, clo được điều chế bằng phương pháp nào? Viết phương trình phản ứng.
Lời giải:
Trong công nghiệp, khí clo được điều chế bằng phương pháp điện phân dung dịch NaCl bão hòa có màng ngăn xốp.
Khí clo thu được ở cực dương, khí hiđro thu được ở điện cực âm, dung dịch thu được là NaOH.
Bài 9 (trang 81 SGK Hóa 9)
Có thể thu khí clo bằng cách đẩy nước được không? Tại sao?
Có thể thu khí clo bằng cách đẩy không khí được không? Hãy giải thích và mô tả bằng hình vẽ. Cho biết vai trò của H2SO4 đặc.
Lời giải:
– Không thể thu khí clo bằng cách đẩy nước vì khí clo tác dụng được với nước:
Cl2 + H2O ⇄ HCl + HClO.
– Có thể thu khí clo bằng cách đẩy không khí và để ngửa bình vì khí clo nặng hơn không khí (M = 71 > M = 29).
H2SO4 đặc để hút nước.
Bài 10 (trang 81 SGK Hóa 9)
Tính thể tích dung dịch NaOH 1M để tác dụng hoàn toàn với 1,12 lít khí clo (đktc). Nồng độ mol của các chất sau phản ứng là bao nhiêu? Giả thiết thể tích dung dịch thay đổi không đáng kể.
Lời giải:
Phương trình phản ứng:
Cl2 + 2NaOH → NaCl + NaClO + H2O
Theo pt: nNaOH = 2. nCl2 = 2. 0,05 = 0,1 mol
nNaCl = nNaClO = nCl2 = 0,05 mol.
Bài 11 (trang 81 SGK Hóa 9)
Cho 10,8g kim loại M có hóa trị III tác dụng với clo dư thì thu được 53,4g muối. Hãy xác định kim loại M đã dùng.
Lời giải:
Gọi M là khối lượng mol của kim loại
2M + 3Cl2 → 2MCl3
10,8 g 53,4 g
Theo pt: nM = nMCl3 ⇒
⇒ M = 27 (g). Vậy M là nhôm (Al)
Trắc nghiệm Hóa học 9 Bài 26 (có đáp án)
Câu 1: Clo là chất khí có màu
A. nâu đỏ.
B. vàng lục.
C. lục nhạt.
D. trắng xanh.
Lời giải
Đáp án: B
Câu 2: Clo là phi kim có độ hoạt động hoá học
A. mạnh hơn photpho, lưu huỳnh nhưng yếu hơn flo.
B. mạnh hơn photpho, lưu huỳnh và flo.
C. yếu hơn flo, lưu huỳnh nhưng mạnh hơn brom.
D. yếu hơn flo, photpho và brom.
Lời giải
Đáp án: A
Câu 3: Nước clo là dung dịch hỗn hợp các chất
A. HCl; HClO.
B. HCl; HClO2; Cl2.
C. NaCl; NaClO.
D. HCl; HClO; Cl2.
Lời giải
Đáp án: D
Câu 4: Clo tác dụng với natri hiđroxit ở điều kiện thường
A. tạo thành muối natri clorua và nước.
B. tạo thành nước javen.
C. tạo thành hỗn hợp các axit.
D. tạo thành muối natri hipoclorit và nước.
Lời giải
Đáp án: B
Cl2 + 2NaOH → NaCl + NaClO + H2O
Nước Gia ven là hỗn hợp hai muối natri clorua (NaCl) và natri hipoclorit (NaClO)
Câu 5: Chất có thể dùng để điều chế clo trong phòng thí nghiệm là
A. mangan đioxit và axit clohiđric đặc.
B. mangan đioxit và axit sunfuric đặc.
C. mangan đioxit và axit nitric đặc.
D. mangan đioxit và muối natri clorua.
Lời giải
Đáp án: A
Câu 6: Trong công nghiệp người ta sản xuất clo bằng cách
A. điện phân dung dịch muối ăn bão hoà .
B. điện phân dung dịch muối ăn bão hoà trong bình điện phân có màng ngăn.
C. nung nóng muối ăn.
D. đun nhẹ kalipemanganat với axit clohiđric đặc.
Lời giải
Đáp án: B
Câu 7: Khi dẫn khí clo vào nước xảy ra hiện tượng
A. vật lí.
B. hoá học.
C. vật lí và hoá học.
D. không xảy ra hiện tượng vật lí và hóa học.
Lời giải
Đáp án: C
Hiện tượng vật lý: một phần khí clo hòa tan vào nước.
Hiện tượng hóa học: một phần khí clo phản ứng với nước theo phương trình hóa học: Cl2 (k) + H2O (l) ⇄ HCl (dd) + HClO (dd)
Câu 8: Các khí có thể tồn tại trong một hỗn hợp ở bất kì điều kiện là
A. H2 và O2.
B. Cl2 và H2.
C. Cl2 và O2.
D. O2 và SO2.
Lời giải
Đáp án: C
Cl2 không phản ứng trực tiếp với O2 nên có thể tồn tại trong một hỗn hợp ở bất kì điều hiện nào.
Câu 9: Phương trình phản ứng viết sai là
Lời giải
Đáp án: A
Phương trình A sai vì
Câu 10: Cho 11,2 gam bột sắt tác dụng với khí clo dư. Sau phản ứng thu được 32,5 gam muối sắt. Khối lượng khí clo tham gia phản ứng là
A. 21,3 gam.
B. 20,50 gam.
C. 10,55 gam.
D. 10,65 gam.
Lời giải
Đáp án: A
Áp dụng định luật bảo toàn khối lượng có: mFe pư + mClo pư = mmuối
→ mclo pư = 32,5 – 11,2 = 21,3 gam.
Câu 11: Cho dung dịch axit có chứa 7,3 gam HCl tác dụng với MnO2 dư. Thể tích khí clo sinh ra (đktc) là
A. 1,12 lít.
B. 2,24 lít.
C. 11,2 lít.
D. 22,4 lít.
Lời giải
Đáp án: A
Câu 12: . Từ bột Fe và một hoá chất X có thể điều chế trực tiếp được FeCl3. Vậy X là
A. Dung dịch HCl.
B. Dung dịch CuCl2.
C. Khí clo.
D. Cả A, B, C đều được.
Lời giải
Đáp án: C
******************
Trên đây là nội dung bài học Hóa học 9 Bài 26: Clo do THPT Ngô Thì Nhậm biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Clo. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường THPT Ngô Thì Nhậm
Chuyên mục: Hoá học 9