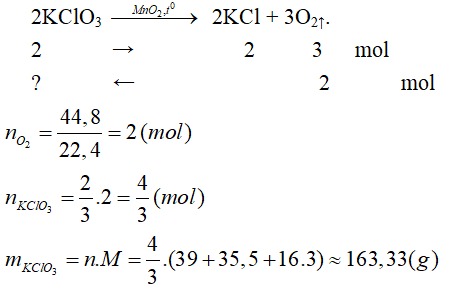Hóa học 8 Bài 27: Điều chế khí oxi – Phản ứng phân hủy được THPT Ngô Thì Nhậm biên soạn hy vọng sẽ là là tài liệu hữu ích giúp các em nắm vững kiến thức bài học và đạt kết quả tốt trong các bài thi, bài kiểm tra trên lớp.
Tóm tắt lý thuyết Hóa học 8 Bài 27
Điều chế oxi
a. Trong phòng thí nghiệm
Đun nóng hợp chất giâu oxi và dễ bị phân hủy ở nhiệt độ cao như kali pemanganat KMnO4 hoặc kali clorat KClO3 trong ống nghiệm, oxi thoát ra theo PT:
2KMnO4 −to→ K2MnO4 + MnO2 + O2
2KClO3 −to→ 2KCl + 3O2
b. Trong công nghiệp
– Sản xuất từ không khí: hóa lỏng không khí ở nhiệt độ thấp và áp suất cao. Trước hết thu được Nitơ (- 196°C ) sau đó là Oxi ( – 183°C)
– Sản xuất từ nước: điện phân nước
Phản ứng phân hủy
Là phản ứng hóa học trong đó từ môtj chất sinh ra nhiều chất mới.
VD: 2KMnO4 −to→ K2MnO4 + MnO2 + O2
2KClO3 −to→ 2KCl + 3O2
Giải bài tập SGK Hóa học 8 Bài 27
Bài 1 (trang 94 SGK Hóa 8)
Những chất nào trong số các chất sau được dùng để điều chế oxi trong phòng thí nghiệm?
a) Fe3O4.
b) KClO3.
c) KMnO4.
d) CaCO3.
e) Không khí.
g) H2O.
Lời giải:
Chọn đáp án: b) KClO3. c) KMnO4.
2KClO3 2KCl + 3O2
2KMnO4 K2MnO4 + MnO2 + O2
Bài 2 (trang 94 SGK Hóa 8)
Sự khác nhau về cách điều chế oxi trong phòng thí nghiệm và trong công nghiệp về nguyên liệu, sản lượng và giá thành?
Lời giải:
Sự khác nhau về cách điều chế oxi trong phòng thí nghiệm (PTN) và trong công nghiệp (CN).
– Nguyên liệu:
PTN: KClO3 hoặc KMnO4(chất giàu oxi, phản ứng thực hiện nhanh, dễ dàng)
CN: Không khí và nước.
– Sản lượng:
PTN: Thể tích nhỏ dùng cho thí nghiệm.
CN: Sản lượng lớn dùng cho công nghiệp và y tế.
– Giá thành:
PTN: Giá thành cao.
CN: Giá thành hạ vì nguyên liệu là không khí và nước.
Cách điều chế trong CN và PTN cũng khác nhau, trong PTN nhiệt phân KClO3 (hoặc KMnO4) còn trong CN từ hóa lỏng không khí hay điện phân nước.
Bài 3 (trang 94 SGK Hóa 8)
Sự khác nhau giữa phản ứng phân hủy và phản ứng hóa hợp? Dẫn ra 2 thí dụ để minh họa.
Lời giải:
Sự khác nhau giữa phản ứng phân hủy và phản ứng hóa hợp.
Phản ứng hóa hợp là phản ứng hóa học trong đó chỉ có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
Thí dụ:
CaO + CO2 → CaCO3.
2Cu + O2 → 2CuO.
Phản ứng phân hủy là phản ứng hóa học trong đó một chất sinh ra hai hay nhiều chất mới.
Thí dụ:
2HgO → 2Hg + O2↑
2KClO3 → 2KCl + 3O2
Bài 4 (trang 94 SGK Hóa 8)
Tính số mol và số gam kali clorat cần thiết để điều chế được:
a) 48g khí oxi.
b) 44,8 lít khí oxi (ở đktc).
Lời giải:
a) Phương trình phản ứng:
b) Phương trình phản ứng:
Bài 5 (trang 94 SGK Hóa 8)
Nung đá vôi CaCO3 được vôi sống CaO và khí cacbonic CO2.
a) Viết phương trình hóa học của phản ứng.
b) Phản ứng nung vôi thuộc loại phản ứng hóa học nào? Vì sao?
Lời giải:
a) Phương trình hóa học của phản ứng:
CaCO3 CaO + CO2.
b) Phản ứng nung vôi thuộc loại phản ứng phân hủy vì từ một chất sinh ra hai chất mới.
Bài 6 (trang 94 SGK Hóa 8)
Trong phòng thí nghiệm người ta điều chế oxit sắt từ Fe3O4 bằng cách dùng oxi hóa sắt ở nhiệt độ cao.
a) Tính số gam sắt và oxi cần dùng để điều chế được 2,32g oxi sắt từ?
b) Tính số gam kali pemanganat KMnO4 cần dùng để có được lượng oxi dùng cho phản ứng trên, biết rằng khi nung nóng 2 mol KMnO4 thì thu được 1 mol O2.
Lời giải:
a) Phương trình hóa học của phản ứng:
3Fe + 2O2 → Fe3O4.
nFe3O4 = = 0,01 mol.
nFe = 3.nFe3O4 = 0,01 .3 = 0,03 mol.
nO2 = 2.nFe3O4 = 0,01 .2 = 0,02 mol.
mFe = 0,03.56 = 1,68g.
mO2 = 0,02.32 = 0,64g.
b) Phương trình phản ứng nhiệt phân KMnO4:
2KMnO4 → K2MnO4 + MnO2 + O2
nKMnO4 = 2.nO2 = 0,02.2 = 0,04 mol.
mKMnO4 = 0,04 .158 = 6,32g.
Trắc nghiệm Hóa học 8 Bài 27 (có đáp án)
Câu 1: Các chất dung để điều chế Oxi trong phòng thí nghiệm là
A. KClO3
B. KMnO4
C. CaCO3
D. Cả A & B
Lời giải
Đáp án: D
Câu 2: Tổng hệ số của chất tham gia và sản phẩm là
2KClO3 −to→ 2KCl + 3O2
A. 2&5
B. 5&2
C. 2&2
D. 2&3
Lời giải
Đáp án: A
Câu 3: Có những cách nào điều chế oxi trong công nghiệp
A. Dùng nghiên liệu là không khí
B. Dùng nước làm nguyên liệu
C. Cách nào cũng được
D. A&B
Lời giải
Đáp án: D
Câu 4: Nhiệt phân 12,25 g KClO3 thấy có khí bay lên. Tính thể tích của khí ở đktc
A. 4,8 l
B. 3,36 l
C. 2,24 l
D. 3,2 l
Lời giải
Đáp án: B
VO2= 0,15.22,4 = 3,36 l
Câu 5: Số sản phẩm tạo thành của phản ứng phân hủy là
A. 2
B. 3
C. 2 hay nhiều sản phẩm
D. 1
Lời giải
Đáp án: C
Câu 6: Chọn nhận xét đúng
A. Phản ứng phân hủy là một dạng của phản ứng hóa học
B. Phản ứng hóa hợp là phản ứng oxi hóa khử
C. Phản ứng phân hủy là phản ứng sinh ra duy nhất 2 chất mới
D. Cả A và C đều đúng
Lời giải
Đáp án: A
Câu 7: Phản ứng phân hủy là
A. Ba + 2HCl → BaCl2 + H2
B. Cu + H2S → CuS+H2
C. MgCO3 → MgO + CO2
D. KMnO4 → MnO + O2 + K2O
Lời giải
Đáp án: C
Câu 8: Cho phản ứng 2KMnO4 −to→ K2MnO4 + MnO2 + O2
Tổng hệ số sản phẩm là
A. 3
B. 2
C. 1
D. 5
Lời giải
Đáp án: A
Câu 9: Tính khối lượng KMnO4 biết nhiệt phân thấy 2,7552 l khí bay lên
A. 38,678 g
B. 38,868 g
C. 37,689 g
D. 38,886 g
Lời giải
Đáp án: B
nKMnO4= 0,246.158 = 38,868 g
>Câu 10: Phương trình không điều chế oxi trong phòng thí nghiệm
A. 2KMnO4 −to→ K2MnO4 + MnO2 + O2 ↑
B. 2H2O2 −to→ 2H2O + O2
C. 2KClO3 −MnO2→ 2KCl + 3O2
D. 2H2O −to→ 2H2 + O2
Lời giải
Đáp án: D
******************
Trên đây là nội dung bài học Hóa học 8 Bài 27: Điều chế khí oxi – Phản ứng phân hủy do THPT Ngô Thì Nhậm biên soạn bao gồm phần lý thuyết, giải bài tập và các câu hỏi trắc nghiệm có đáp án đầy đủ. Hy vọng các em sẽ nắm vững kiến thức về Điều chế khí oxi – Phản ứng phân hủy. Chúc các em học tập thật tốt và luôn đạt điểm cao trong các bài thi bài kiểm tra trên lớp.
Biên soạn bởi: Trường THPT Ngô Thì Nhậm
Chuyên mục: Hoá học 8